资讯中心
作者:香雪生命科学-叶佳琳
发布时间:2023-03-29
阅读:14649
自DNA的双螺旋结构被发现后,分子生物学就进入了一个蓬勃发展期,人类对于基因的探索兴趣也越来越浓厚,生物的遗传信息逐渐被破译。同时在疾病治疗方面,基因治疗的出现给遗传性疾病患者及肿瘤患者带来了新希望。基因转移技术是基因治疗的关键影响因素之一,如何进行有效的基因递送并不断提高基因的效率是研究者们一直以来在攻克的难题。常用的外源基因导入的方法包括物理法、化学法和生物法,接下来浅浅了解一下这几种方法:
一、 物理法:
1. 基因枪法:
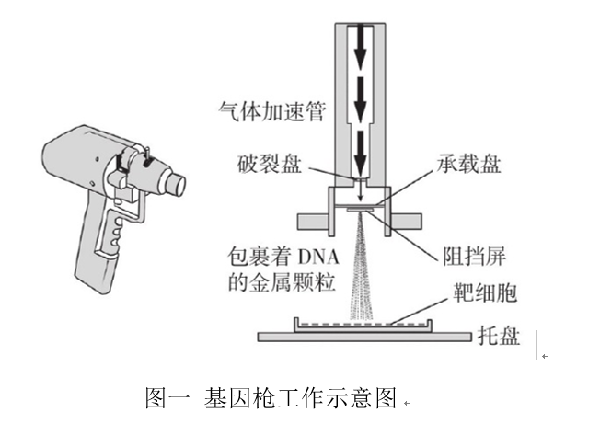
先将外源基因如DNA分子吸附于直径约为4 μM的钨粒或者金粒上,就像是组成了“子弹”。气体基因枪利用压缩气体(氦或氮等气体)作为动力驱动,将包裹着DNA的金属微粒子弹加速到一个很高的速度后,穿透细胞壁、细胞膜、细胞质等结构到达细胞核,完成外源基因的导入[1]。基因枪轰击可能对细胞造成较大的伤害,因此很少细胞符合基因枪法的要求。目前这种方法常用于植物细胞的基因转导,转化率高且重复性较好。
2.电激法:
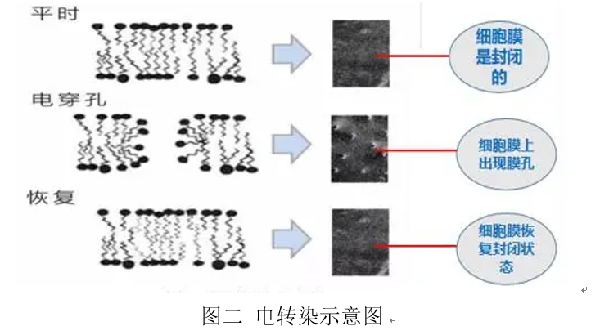
电激即细胞电转染,也叫做细胞电穿孔,是通过外部瞬时、高强度的电场作用,使细胞膜具有一定的通透性,并在电脉冲的作用下形成可逆性的穿孔,使得外源基因可以进入。但基因并不是可以直接进入细胞内的。细胞的细胞膜-细胞质-细胞核在电场中就相当于是串联电路,细胞膜的阻力比较大,在电场中的分压就比较大,细胞质的电阻较小则分得的电压也很小,因此电场的作用只让外源基因停留在细胞膜附近。接着细胞本身的机制可以让这些外源基因慢速扩散进入细胞内。能承受电转能量的细胞,细胞膜承受了大部分的电压,其细胞核承担的电压微乎其微,因此电转不会造成对细胞原本内部基因的毒性[2]。电转的方法可以瞬时和稳定地表达外源基因,因此常用于科研领域的新药开发、癌症研究、免疫学研究等。
3. 显微注射法[4]:
显微注射法是用针管极细的玻璃注射管,穿破细胞膜将外源基因直接打进细胞内。因细胞膜具有一定的弹性和流动性,因此细胞膜在被刺破后可进行修复,恢复好的细胞可以继续生长。显微注射法对于外源基因的长度限制较宽松,可以导入大片段的基因片段,但对仪器以及操作方法要求及其严格,且一次只能操作少量细胞,因此不适用于需大量的研究,常用于转基因植物或者克隆动物的研究中。
4. 激光穿刺法
激光穿刺与电转有相似之处,通过微米级的激光光束在细胞上穿孔,使外源基因进入细胞内。在激光处理前,细胞需先在高渗溶液中浸泡一定的时间,使细胞内保持较高的渗透压,当激光处理细胞后,外源基因便因为细胞内外形成的渗透压差,通过穿刺的小孔进入细胞内[5]。这种方法操作比较简便、受体材料范围广且不受转化方法的限制。此方法在有植物细胞或组织的基因工程中具有广泛的应用前景。
5. 超声波法[3]
超声波法主要利用的是空化作用,即超声波的作用下,液体中球形的空化泡在崩溃的瞬间,其内部可产生高温高压,此时可能出现电离和放电效应,使在空泡周围的细胞壁和质膜破损或者发生可逆性的通透性改变,从而发生细胞内外物质的交换,使得溶液中的外源基因进入细胞内。
6. 碳化硅纤维法
碳化硅纤维是一种以有机硅化合物为原料,具有β-碳化硅结构的无机纤维。将悬浮细胞与DNA和碳化硅纤维混合并震荡培养,DNA与碳化硅纤维混合后可依附在其表面,碳化硅纤维在与细胞相互碰撞过程中可以刺穿细胞,进而将DNA导进细胞内。这种方法转导DNA的成本低易操作且可以控制导入DNA的量,但是也会对细胞造成及较大的伤害,因此通常应用于具有细胞壁的植物细胞基因转导中。
二、 化学法:
1. 聚乙二醇(PEG)法
聚乙二醇(PEG)是由环氧乙烷与水或乙二醇聚合而成的高分子聚合物。PEG无色无毒无刺激性气味,具有一系列的分子量,与水有较好的相溶性。PEG的表面带正电,可与带负电的DNA分子通过静电作用结合,从而在DNA分子上形成PEG包膜。PEG可以与细胞膜粘合进而扰乱细胞膜的磷脂双分子层,使细胞膜表面的膜电位紊乱,干扰细胞膜的识别作用。高浓度PEG具有高亲水性,可吸附溶液中的自由水分子,从而使细胞膜和DNA分子之间形成分子桥,促进两者的接触粘合使DNA得以进入细胞内[6]。PEG包裹法在基因治疗研究的前期探索阶段应用较为广泛,在帮助基因导入的前提下降低了外源基因对细胞的伤害。
2. 磷酸钙-DNA共沉淀
磷酸钙-DNA 共沉淀法(calcium phosphate-DNA coprecipitation)是先将DNA与氯化钙(CaCl2)混合,然后加入到PBS或者HEPES等带有磷酸根基团的溶液中,正电荷的钙离子会与负电荷的磷酸根离子形成沉淀,同时DNA也会吸附在上面。将带有沉淀的悬液滴入细胞培养皿中与细胞共培养,细胞可以吞噬沉淀,进而将DNA带入细胞内。这种方法常用于单层贴壁细胞的基因转导中,是成本较低且简易的转导方法。但是这种方法的转染效率较低,很多时候不能满足研究工作的需要。
3. 脂质体法
细胞膜是由磷脂双分子组成的,想跟它打好关系最好的办法就是融入它。因此便有了脂质体转染法。脂质体也被叫做人工细胞膜,具有磷脂双分子层。表面带正电荷的脂质体与DNA(或RNA)分子的磷酸根通过静电作用结合,脂质体将分子包裹在内,细胞膜的表面也是带负电荷的,因此可以吸附脂质体,最后融合通过内吞的方式将分子带入细胞内。这种方法的基因转导率高,而且不仅可以转导小片段基因分子,对于大片段的基因分子也有很高的转导效率,因此在科研研究中得到了非常广泛的应用[7]。但是脂质体转染法的成本较高,具有一定的细胞毒性,不适用于大剂量的研究。

三、 生物法:
生物法大多用于植物的转基因研究中。
1. 农杆菌介导法
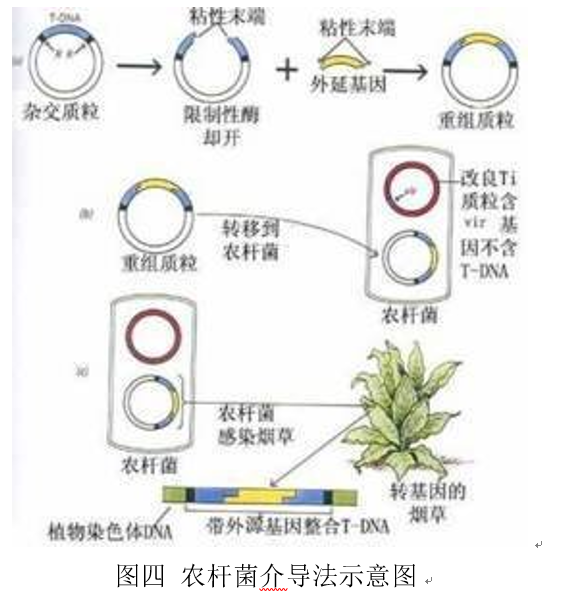
农杆菌是一类革兰氏阴性的细菌。农杆菌中的根癌农杆菌上有一种可以使植物产生肿瘤的质粒,叫做Ti质粒(Tumor inducing plasmid)。Ti质粒上有一小段可以进入植物细胞内部的序列(T-DNA,Transfer DNA)。T-DNA可以插入到植物细胞的基因中,因此研究者则通过改造T-DNA,将外源基因插入到T-DNA中,然后通过农杆菌侵染植物细胞便可以获得转基因植物。受感染的植物细胞需为受伤的双子叶植物细胞,其会释放一些生物信号,这些信号吸引农杆菌靠近,吸附于植物细胞表面。随后农杆菌上T-DNA的毒粒基因被激活表达,帮助引导DNA穿过农杆菌的内外膜以及植物细胞的细胞壁、内外膜和核膜,而农杆菌并不会进入细胞[8]。农杆菌介导是天然的植物遗传转化系统,在转基因植物的研究中受到了广泛的青睐。
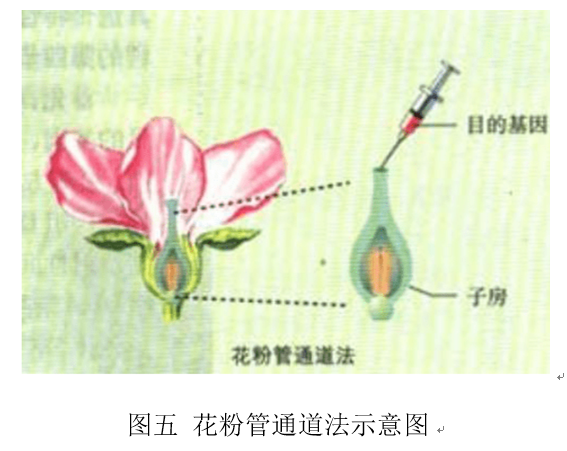
2. 花粉管通道法[9]
植物细胞在开花授粉后,会形成花粉管,花粉管伸长后借助助细胞进入胚囊中。人工将外源基因借助花粉管导入胚囊中,外源基因进一步整合到早期还没有形成细胞壁的合子中,形成有外源基因的胚,最后经过培养以及筛选得到目的产物。花粉管通道法不用依赖于植物细胞组织培养,可以直接得到转基因的种子。
3. 浸渍法
浸渍法是植物细胞基因转导最简单,成本最低的方法。该方法即是通过将植物的种子、胚、胚珠、子房或者悬浮细胞直接浸润在含有外源基因的溶液中,通过细胞自身的渗透作用将外源基因导入细胞中。这种方法的转化效率低,重复率差,过程的筛选也比较困难。
4. 病毒介导法
病毒大家也都不陌生了。简单的病毒是由核酸(DNA或RNA)作为中心,和蛋白质组成的外壳构成的。病毒不能自主繁殖,必须借助活细胞内的物质和能量进行繁殖。病毒具有较强的感染能力,通过基因工程手段改造病毒基因组,将外源基因插入病毒基因组中,成为外源基因的运送载体,随后将病毒载体进行包装,制备成携带外源基因且具有细胞感染能力的病毒颗粒。改造后的病毒感染宿主细胞,外源基因进入细胞内,并进行长期的基因表达。目前最常用的病毒载体有逆转录病毒(Retrovirus,RV)、腺病毒(Adenovirus,ADV)和慢病毒(Lentivirus,LV)。病毒介导法的受体细胞广泛,可以满足植物细胞以及动物细胞的基因转导,转导效率高且基因表达较稳定,是目前基因治疗研究中常用的基因转导方法[10]。
基因转导在动植物的研究中具有重要的意义,转基因食品的出现大大提高了农作物的产量、减少了害虫的伤害;基因治疗的研究为癌症病人带来了新希望。基因转导虽然带来了诸多益处,但对生物体来说属于外源物质,存在基因突变导致机体调控失调等的风险,因此对于转导基因的设计、转导方法的选择等都需要长时间的研究摸索。
参考文献:
[1] Wang, Jun, et al. "Research progress of gene gun bombardment in genetic transformation." Genomics and Applied Biology 37.1 (2018): 459-468.
[2] Cervia L D, Yuan F. Current progress in electrotransfection as a nonviral method for gene delivery[J]. Molecular pharmaceutics, 2018, 15(9): 3617-3624.
[3] Ohta S, Suzuki K, Ogino Y, et al. Gene transduction by sonoporation[J]. Development, growth & differentiation, 2008, 50(6): 517-520.
[4] Zhang Y, Yu L C. Microinjection as a tool of mechanical delivery[J]. Current opinion in biotechnology, 2008, 19(5): 506-510. [5] Lanlan W, Rongzhao F, Guiying S, et al. Introduction of exogenous genes into wheat using puncture technique of microbeam laser[J]. Yi Chuan xue bao= Acta Genetica Sinica, 1995, 22
(5): 394-399.
[6] Lee M, Kim S W. Polyethylene glycol-conjugated copolymers for plasmid DNA delivery[J]. Pharmaceutical research, 2005, 22: 1-10.
[7] Kikuchi H, Suzuki N, Ebihara K, et al. Gene delivery using liposome technology[J]. Journal of controlled release, 1999, 62(1-2): 269-277.
[8] Tzfira T, Citovsky V. Agrobacterium-mediated genetic transformation of plants: biology and biotechnology[J]. Current opinion in biotechnology, 2006, 17(2): 147-154.
[9] Huang G, Dong Y, Sun J. Introduction of exogenous DNA into cotton via the pollen-tube pathway with GFP as a reporter[J]. Chinese Science Bulletin, 1999, 44: 698-701.
[10] Giacca M, Zacchigna S. Virus-mediated gene delivery for human gene therapy[J]. Journal of controlled release, 2012, 161(2): 377-388.