
资讯中心
作者:香雪生命科学-王定国
发布时间:2023-02-23
阅读:10784
12世纪最杰出的哲学家彼得·阿贝拉德(Peter Abélard)曾经说过:“The beginning of wisdom is found in doubting; by doubting we come to question, and by seeking we may come upon the truth.”智慧的开始源自怀疑;通过怀疑,我们质疑问题,通过寻求探索,我们可以找到真理。本篇文献翻译(节选[1]), 我们来深入了解一下与CD8αβ截然不同的CD8αα,正是因为对CD8αα的不断怀疑,科学家对CD8αα有了更多的认识。
摘要:CD8是一种表达在造血细胞上的糖蛋白。CD8的两种亚型,即CD8αβ和CD8αα,已经被证实在表达和功能上是不同的。CD8αβ作为TCR的辅助受体,增强其功能亲和力(avidity),并组成性地表达于MHC I类限制性的T细胞上,而表达CD8αα的T细胞,则与传统胸腺选择的、MHC限制的CD4+或CD8αβ+ T细胞不同。与CD8αβ辅助受体功能不一致的是,CD8αα降低TCR的抗原敏感性,并且它可以瞬时或者永久地表达于T细胞上,无论该T细胞的MHC限制性或者是否存在传统辅助受体。也就是说,CD8αα可以表达在CD4+或者CD8+ T细胞上,也可以和CD8αβ同时表达在同一T细胞上。这些发现表明,T细胞上的CD8αα标志着一个特殊的分化阶段,它很可能作为TCR的共抑制受体,负向调节T细胞的活化。
前言:CD8αα在T细胞上表达时,经常被认为是一种无效的TCR辅助受体。与传统的TCR辅助受体CD4和CD8αβ类似,CD8αα也结合MHC配体,并被作为谱系决定因子,以鉴定在多个方面(如:起源、个体发生、特异性、功能)偏离主流T细胞亚群的T细胞。在小鼠中,CD8αα单阳性(SP)T细胞在小肠上皮内淋巴细胞(IEL)中占主导地位,并且通常显示出活化的表型,同时具有先天性的特征。此外,CD8αα和CD8αβ在胸腺细胞上的调节是灵活的,取决于其发育阶段。CD8αα也可以与CD4或CD8αβ一起表达在活化的成熟TCRαβ+ T细胞上,这意味着CD8αα可能不是作为一种传统的与MHC I类结合的TCR辅助受体。
表达CD8αα的成熟T细胞的激活状态表明CD8αα与TCR-CD3复合物之间存在关系。CD8αα在TCRγδ+以及TCRαβ+细胞上表达,或与CD4、CD8αβ一起在MHC II类或MHC I类限制的T细胞上表达,表明这种关系不受TCR或辅助受体性质的限制,而且与MHC的限制性也无关。这些发现也暗示了,CD8αα和TCR-CD3激活复合体之间的联系不是由TCR介导的,而是与CD3复合体信号模块之间存在功能上的联系。CD8α胞质尾与早期Src激酶p56lck和T细胞激活连接体(LAT)相结合,将CD8αα连接到近端和远端的TCR-CD3激活信号传导级联上,其中,p56lck的作用是对CD3上的“免疫受体酪氨酸激活基序”(ITAMs)进行磷酸化,LAT的作用是介导进一步的下游信号传导。尽管有这种结合,且尽管CD8αα与MHC I类配体有相互作用的能力,但CD8αα既不支持对MHC I类限制性胸腺细胞的正向选择,也不能有效地促进CD8依赖的MHC I类限制性的TCR的激活。进一步地,当与CD8αβ一起表达时,CD8αα可能会降低而不是增强CD8αβ-TCR:Ag-MHC激活复合物的功能亲和力,这意味着CD8αα对TCR-CD3激活复合物的作用是抑制性的。CD8αα的差异性、独立性、高度调控的表达以及其独特的生物学特点表明CD8αα不是CD8αβ的功能同源物,却表明CD8αα可能作为一种有效的TCR共抑制受体,而不是功能性的TCR辅助受体。
CD8αα的抑制受体功能: 历史上,CD8αα一直被用来作为研究CD8功能的方便分子。通过CD8α基因的转导,表明CD8αα可以作为一个粘附分子发挥作用,能够与未被TCR结合的MHC I类配体相互作用而加强整体的亲和力。无尾的CD8αα可以在同样程度上增强反应性,这表明CD8αα的粘附作用完全取决于其胞外部分与MHC I类分子的相互作用。然而,细胞-细胞间的结合试验或可溶性分子的SPR分析表明,与CD8αα相比,CD8αβ并没有增加细胞粘附性或对MHC I类配体的亲和力,这与CD8αβ TCR 辅助受体的增强功能不同。这种由CD8αα或CD8αβ介导的类似粘附作用,与更高级的膜结合形式的CD8αβ作为TCR辅助受体的功能是截然不同的。因此,强调CD8β作为有效的CD8 TCR辅助受体标志的重要性,也相当于支持CD8αα不是CD8αβ TCR 辅助受体功能同源物的观点。当TCR与弱抗原结合时,需要有高效的CD8αβ辅助受体功能而不是增加粘附性,这一现象意味着TCR辅助受体的功能是增强低亲和力TCR的抗原敏感性。因此,具有低亲和力TCR的T细胞在激活和初始选择时依赖于辅助受体。考虑到这一点,一项用逆转录病毒将CD8依赖性和非依赖性TCR(也即低亲和力和高亲和力TCR)分别转导到从野生型或CD8β缺陷型小鼠分离的原代T细胞的研究表明,CD8αα不能支持CD8依赖性TCR(即低亲和力TCR)的激活,进而说明CD8αα不具有TCR辅助受体功能。相反,在没有辅助受体的情况下依然发挥作用的高亲和力TCR出现在双阴性(DN)T细胞上,这些T细胞却经常表达CD8αα。CD8αα与高亲和力的TCR一起表达,或者是通过增加TCR信号强度对CD8αα的诱导,都进一步使人们怀疑CD8αα作为一个辅助受体来提高TCR抗原敏感性的功能。在双阴性(DN)胸腺细胞上强制转基因表达CD8αα大大削弱了细胞内钙反应,并阻断了对TCR应答反应时信号通路组分的有效酪氨酸磷酸化,这表明CD8αα可能作为TCR的一个负调控器发挥作用。以此一致的是,用TCR的转基因细胞系(表达相同亲和力的TCR)已经证明了,当与CD8αβ共表达时,CD8αα能够特异性地抑制由CD8αβ介导增加的抗原敏感性。
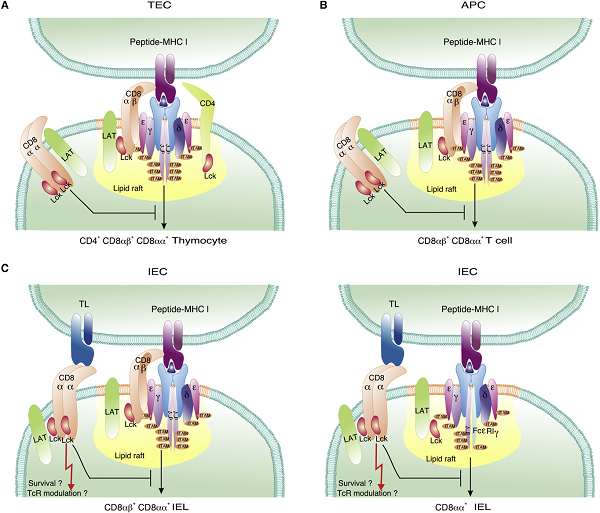
图1.CD8αα共抑制受体在不同细胞类型上的功能
与传统的辅助受体CD8αβ和CD4不同,CD8αα抑制受体被排除在脂质筏之外,脂质筏含有与抗原呈递MHC分子相结合的TCR-CD3(CD3ζ 和/或 FcεRγ+)激活复合物。CD8αα共抑制受体通过破坏脂质筏和封闭TCR启动下游信号传导所需的信号分子来负向调节TCR的激活。
(A)CD4+CD8αβ+CD8αα+ 三阳的胸腺细胞在胸腺激动剂选择期间与MHC和自身抗原相互作用。CD8αα抑制受体可能封闭Lck和LAT,使得从激动剂选择TCR接收到的信号强度暂时性降低。
(B) 一些外周的CD8αβ+T细胞在被激动剂配体初级激活后会短暂地诱导CD8αα。这些激活的T细胞上的CD8αα抑制受体可能临时性地封闭Lck和LAT,使得通过激动剂触发的TCR所接收的信号强度暂时减少。
(C) 左图:传统的辅助受体依赖的效应T细胞在肠道微环境的条件下重新产生CD8αα。CD8αα抑制受体的组成性存在可能会提高这些位于抗原丰富的肠道环境中的有抗原经历的T细胞的激活阈值。CD8αα可能与它的配体TL相互作用,TL由肠道上皮细胞大量表达(其α3上有氨基酸突变,不能递呈抗原肽),并促进有抗原经历T细胞的长期存活。右图DN TCRαβ+胸腺细胞迁移到肠道后重新产生CD8αα。在这些自身特异性辅助受体非依赖性T细胞上CD8αα抑制受体组成性地表达可能阻止异常的自我反应。CD8αα与TL配体的相互作用可以促进这些有自身抗原经历T细胞的长期存活。
与包括CTLA-4在内的其他TCR共抑制受体类似,CD8αα可以通过TCR-CD3复合物在激活时被诱导,诱导程度与信号强度正相关。激活诱导的CD8αα与激活复合体的功能亲和力直接相关,而与所参与的TCR对CD8αβ辅助受体的依赖性成负相关。因为CD8αα的共同表达有效地降低了TCR的功能亲和力,并明显减少或完全消除了激活,所以可以得出结论,CD8αα不是一个冗余的辅助受体,而是更有可能作为一个有效的TCR共抑制受体来发挥作用。由于CD8αα可以在已激活的CD8αβ+T细胞上被瞬时诱导或在IEL上组成性地表达,其抑制作用既可以暂时性地降低功能亲和力,减弱持续的免疫应答(图1B),也可以永久性地增加有抗原刺激经历的T细胞重新激活所需的最小信号强度(图1C)。尽管目前还不完全了解CD8αα是如何作为共抑制受体发挥作用的,但它与MHCI类配体相互作用的能力以及它与TCR-CD3复合物的各种信号成分联系的能力表明,CD8αα有可能在不同层次上干扰TCR介导的激活。
与CD8αβ连同TCR-CD3激活诱导的共内化不同,CD8αα的表达随着激活而增加,反映了CD8αα与TCR-CD3激活复合物之间的脱节关系,这与它被排除在脂质筏之外的结果是一致的。脂质筏外侧CD8αα表达的增加与激活复合物功能亲和力的降低相一致,暗示CD8αα被排除在脂质筏之外可能是其抑制作用的关键。因此,CD8αα可能与非脂质筏相关(non-lipid-raft-associated)的p56lck和LAT结合,从而将这些信号组分从CD8αβ和TCR-CD3激活复合物中分离出来(图1)。尽管这是一个合理的假设,但CD8αβ辅助受体与p56lck和LAT有效结合能力的增强,表明还有其他机制与脂质筏的排斥作用一起,共同有助于CD8αα的抑制作用。CD8αβ与TCR-CD3激活复合物的有效共定位取决于脂质筏的完整性和更大的膜平台组织。CD8αα的表达显著降低了CD8αβ和TCR-CD3的共定位和关联性,这可能表明CD8αα主动破坏了脂质筏的完整性,从而破坏了CD8αβ与TCR的最佳关联性。脂质筏破坏作为一种干扰TCR-CD3激活的机制已经被报道过,在包括CTLA-4在内的其它TCR抑制因子。与CD8αα-CD8αβ辅助受体对类似,CTLA-4与它的竞争者CD28一样与B7配体相结合,但显示出相反的功能:CD28作为TCR的共刺激受体,而CTLA-4介导对TCR的抑制活性。CTLA-4的诱导也与TCR信号强度有关,综合这些结果表明,脂质筏破坏和对信号分子共定位的干扰可能是TCR辅助受体配对阻遏物的一个普遍特征。CD8αα的抑制活性并不限于CD8αβ,CD8αα介导的对双阴性胸腺细胞的抑制作用,暗示其可以直接起到负调控TCR-CD3复合物的作用,而与传统的TCR辅助受体无关(图1C)。
CD8α的细胞质尾部不包含任何典型的抑制性受体免疫受体酪氨酸抑制基序(ITIMs)。相反,CD8αα可以积极地与抑制性分子结合,就像所报道过的LAG-3那样,LAG-3是一种与TCR辅助受体CD4有密切同源性的TCR激活诱导的抑制物。与CD8αα-CD8αβ受体对类似,LAG-3与CD4共享MHC II类配体,但LAG-3会通过积极招募细胞内抑制分子,部分负调控TCR-CD3的激活。虽然还没有发现直接与CD8α胞质尾部结合的特异性抑制分子,但我们很容易能够推测,B细胞激活的连接物LAT2,一种LAT的同源物,在幼稚T细胞中不表达,但在激活的T细胞上会被瞬时诱导表达且在CD8αα+IEL中大量表达,可能作为CD8αα的一种抑制因子。尽管LAT2在与包括FcεRIγ在内的含ITAM的激活受体结合时也会被磷酸化,但它可以主动与LAT竞争,负向调节其在T细胞中的活性。值得注意的是,在激活的T细胞上瞬时诱导表达的CD8αα和LAT2以及它们在CD8αα+ IEL上组成性表达,也与瞬时或组成性表达的FcεRIγ相吻合(图1C)。在T细胞中,FcεRIγ可以参与形成CD3复合物,可以取代CD3ζ二聚体或与CD3ζ形成异质二聚体。每条CD3ζ链中存在的三个ITAM基序,而每个FcεRIγ单元只有一个ITAM,因此,CD3磷酸化位点的减少,加上LAT2对LAT的抵消作用和CD8αα的存在,这些抑制机制协同作用,提高了T细胞有效激活的阈值。膜结合的CD8αα负向调节辅助受体依赖性或辅助受体非依赖性TCR的激活,与其胞外结构域是否与抗原呈递的MHC I类分子有效结合无关。这与可溶性CD8αα(sCD8αα)分子或封阻MHC和CD8αβ辅助受体之间相互作用的CD8α衍生肽的作用形成鲜明的对比。sCD8αα的干扰导致CD3ζ的酪氨酸磷酸化受到抑制,并表明sCD8αα的阻断针对的是激活的最早阶段,这与p56lck激活的抑制相一致。sCD8αα的抑制作用不影响DN T细胞上表达的高亲和力TCR,意味着sCD8αα的抑制机制专门针对的是需要CD8αβ共受体功能才能激活的低亲和力TCR。用阻断CD8αβ与MHC配体相互作用的CD8抗体也观察到类似的抑制作用。sCD8αα的抑制作用是非常有效的,只有少数CD8αβ-MHC I类的相互作用需要被sCD8αα阻断,以防止T细胞的激活。sCD8αα产生于选择性剪接的mRNA,其中编码跨膜结构域的外显子已被删除。sCD8αα在人类中自然发生,与多种疾病的晚期相关,包括T细胞白血病、类风湿性关节炎、多发性硬化症、系统性红斑狼疮和HIV感染。在小鼠中,一种可选择性剪接形式的CD8α也同样被报道,但与人类的sCD8αα不同,小鼠CD8α mRNA保留了跨膜结构域,形成了一种尾部缺失的膜结合CD8α'分子。尽管所有的T细胞都转录和翻译CD8α',但只有未成熟的胸腺细胞在其细胞表面表达CD8α'β异二聚体,而成熟的T细胞则在细胞内保留末端唾液酸化的含CD8α'的复合体。膜结合的CD8α'缺乏与p56lck结合的能力,因此,即使它有一个完整的细胞外结构域,可以与MHC I类分子相互作用,但它不能作为TCR共受体亚单位发挥作用。值得注意的是,在低等脊椎动物中表达的CD8α的祖先形式也保留了原型CD8 Ig样外结构域以及铰链和跨膜结构域,而它在细胞质部分缺乏p56lck一致性结合基序,暗示这两个物理上相连的功能单元可能是分别进化而来的。
结论:由于与CD8αβ辅助受体在结构上有惊人的同源性,CD8αα的外表具有欺骗性,人们对它有很多假设。这种误解不仅导致了对CD8αα功能的错误解释,而且还对表达CD8αα的T细胞的个体发生和功能产生了深刻的混淆和误解。CD8αα的存在已被用作非常规IEL及其胸腺前身细胞,以及常规的CD8αβ+记忆前体细胞的标志。若假设该分子是多余的、无效的辅助受体时,T细胞上CD8αα的表达仅仅是一个无关紧要的标记。当CD8αα被认为是在未成熟的胸腺细胞或初级效应细胞上诱导的强有力的共抑制受体时,或在肠道中有抗原经历的成熟细胞上重新表达时,CD8αα作为激活和分化的关键调控者的重要性就毋庸置疑了。总之,考虑CD8αα的抑制功能是非常重要的,包括对该分子今后的分析,对CD8αα在T细胞分化过程中作用的重新解释,以及对围绕表达CD8αα的T细胞的个体发育和功能争议的重新解释。
1. Cheroutre H, Lambolez F: Doubting the TCR coreceptor function of CD8alphaalpha. Immunity 2008, 28(2):149-159.