
资讯中心
作者:香雪生命科学-梁植雯
发布时间:2022-06-17
阅读:15772
在当下的肿瘤治疗领域中,TCR-T(T-cell receptor engineered T cell therapy)是最受关注的免疫治疗方法之一,香雪生命科学的一款国内首批的TCR-T产品临床研究成果在2022年美国肿瘤学会(ASCO)年会中进行了口头汇报,引起了业界的高度关注。
TCR-T疗法是通过基因工程手段对T细胞进行改造,使得改造后的T细胞能够表达高效识别肿瘤细胞的TCR,从而达到直接杀伤肿瘤或激发机体的免疫应答杀伤肿瘤细胞的目的。
人类成熟外周T细胞中,90% 以上的T细胞都为由α,β两条链编码的αβT细胞,在辅助受体CD8和CD4的共同作用下,分别能特异性识别MHCI类和MHCII类抗原递呈分子。此类TCR具有MHC限制性,只能识别由MHC递呈的抗原多肽。在T细胞介导的免疫反应中,不仅需要TCR与pMHC特异性结合,还需要共受体CD3将信号传递到细胞中才能使T细胞激活和分化,产生免疫应答。
TCR是如何被活化的?近几年,有科学家在这问题上提出了新的研究成果。浙江大学陈伟课题组与中科院娄继忠课题组于2019年在《Molecular Cell》中发表了关于TCR与pMHC分子识别机制的研究成果。此前,陈伟教授已经提出了机械力会增强TCR与激动型抗原之间的相互作用,进而放大“自我”与“非我”的识别差异这一观点,而新的研究则是在此基础上进一步探究这个过程中的分子机制。该研究指出,机械力先通过增强抗原热点残基和TCR的结合,引起MHC发生构象变化,诱导产生新的氢键,从而延长TCR与pMHC的结合时间,形成逆锁键(catch bonds)进而激活T细胞,同时,当这种效应受到阻碍时,T细胞的激活会受到限制。这揭示了力诱导的MHC构象变化对激活TCR与pMHC之间形成逆锁键起到关键作用。当然,相关的机理还有很多值得挖掘和探究的部分,但该研究在对TCR与pMHC的相互作用机制的研究上又迈进了一步。
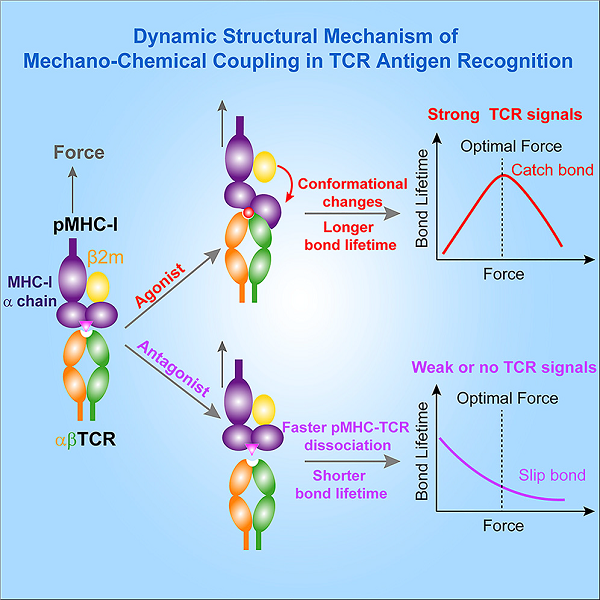
是否只要TCR与pMHC有结合就能激活T细胞使其杀伤癌细胞呢?在T细胞的激活过程中,αβTCR与pMHC的相互作用强度起到关键性的作用,当亲和力在1~10μmol/L的阈值时,T细胞可以被激活从而杀伤靶细胞;但当亲和力低于10μmol/L时,T细胞一般不能被激活。在针对肿瘤抗原时,由于成熟的T细胞对自身抗原识别能力较低,所以一般都难以激活T细胞。因此,若需要利用TCR-T的手段对肿瘤病人进行治疗,首先需要通过基因工程的手段对TCR进行改造,使TCR对自身肿瘤特异性抗原的亲和力在合适的范围内,从而诱导T细胞杀伤肿瘤细胞。
近期,有科学家就关于“什么才是影响T细胞激活的关键影响因素”的问题提出了不一样的看法。澳大利亚莫纳什大学Nicole Gruta团队于2021年在《Science》中发表了关于T细胞信号传导的重要成果。该研究利用包含单个结合关键氨基酸替换的H-2Db-NP366四聚体,与此前曾提到的能与H-2Db-NP366表位结合的两个180°反转方向天然TCR进行实验论证。研究发现,TCR的激活与对接极性有关而非亲和力,TCR与pMHCI对接的拓扑结构是体内免疫招募的关键因素。经典的TCR-pMHCI对接所介导的信号通过CD8对Lck的信号传递大幅增强。而反转的TCR-pMHCI对接虽然不影响TCR-CD3结构的形成,但由于影响了CD3和CD8等关键信号分子的共定位,使得TCR无法被免疫反应所招募,无法激活T细胞。这说明,想要真正有效激活T细胞,单纯满足亲和力的要求或许是不够的,还要考虑TCR与pMHC对接时信号分子是否能真正传递信号,同时,这种信号的负调节也可以对TCR进行功能限制。
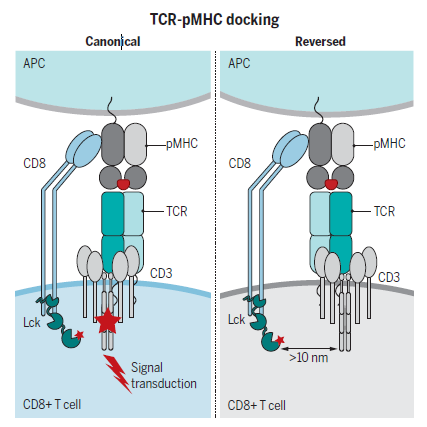
尽管这些新的研究还有很多值得探讨的问题,但这些新的观点与发现能帮助业内人员对T细胞激活的机理有进一步的了解,也给T细胞免疫治疗的研发带来一定的启发。
参考文献
[1] Wu P , Zhang T , Liu B , et al. Mechano-regulation of Peptide-MHC Class I Conformations Determines TCR Antigen Recognition[J]. Molecular Cell, 2019.
[2] Pirooz Z , Christopher S , Carine F , et al. Canonical T cell receptor docking on peptide-MHC is essential for T cell signaling[J]. Science (New York, N.Y.), 372(6546):eabe9124.