
资讯中心
作者:香雪生命科学-孙含丽
发布时间:2022-07-26
阅读:14204
mRNA于20世纪60年代初被首次发现,是连接基因和蛋白质的桥梁。全球肆虐的新冠疫情使mRNA成为备受瞩目的研究领域,加速了mRNA技术的普及和商业化,促使美国FDA于2021年8月23日和2022年1月31日完全批准了两款mRNA新冠疫苗,分别是辉瑞/BioNTech合作开发的Comirnaty(BNT162b2)与Moderna公司开发的Spikevax(mRNA-1273)。这两款疫苗此前分别已于2020年12月2日和2020年12月17日获得紧急使用授权。
传统的疫苗工艺依赖于生物反应装置或在鸡胚中使用哺乳动物细胞批量生产疫苗,而mRNA疫苗只需在接种者体内经过一次转化就可以发挥作用。可以说mRNA是利用人体作为“生物反应装置”,这一过程具有以下几项优势:
首先,mRNA允许人体对编码蛋白进行翻译后修饰(PTM),这种蛋白免疫原性低、可完全发挥作用。其次,在生物反应器中不能产生的多聚体蛋白可以在接种者细胞内完成正确的翻译、折叠和组装。此外,mRNA疗法可以产生跨膜蛋白和细胞内蛋白,并可在细胞中将这些蛋白转运到适当的位置发挥作用。
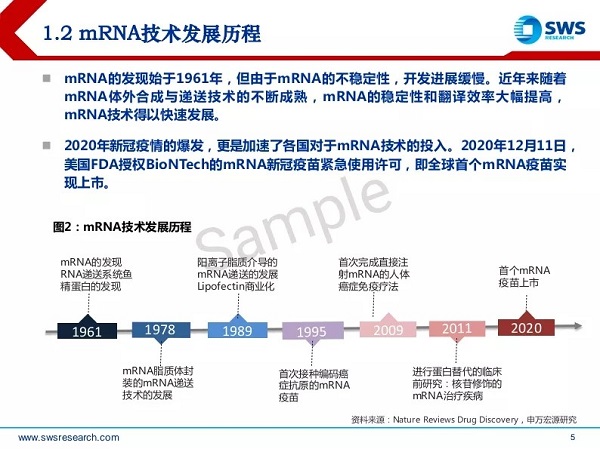
图1 mRNA技术发展历程
从发展历程来看,mRNA从发现到首个产品上市用了接近60年的时间, 直到2020年mRNA新冠疫苗问世,mRNA技术才迎来应用方面的快速发展。mRNA技术三巨头(Moderna、BioNTech和CureVac)于2019年前后上市,我国mRNA技术行业在此阶段也开始蓬勃发展。mRNA技术商业化应用主要有两个关键问题需要解决: 一是mRNA的结构稳定性,二是将mRNA递送至靶细胞的递送系统。这两个问题一直是困扰行业发展的瓶颈,直到2015~2019年,LNP(Lipid nanoparticle)递送技术及核酸序列修饰技术的逐渐成熟,才给mRNA行业发展带来充足动力。现阶段商业化应用的mRNA序列由5部分组成:5’帽子结构 (5’Cap)、5’非翻译区(5’UTR)、开放阅读框(ORF)、3’非翻译区(3’UTR)、3’Poly(A)尾巴。
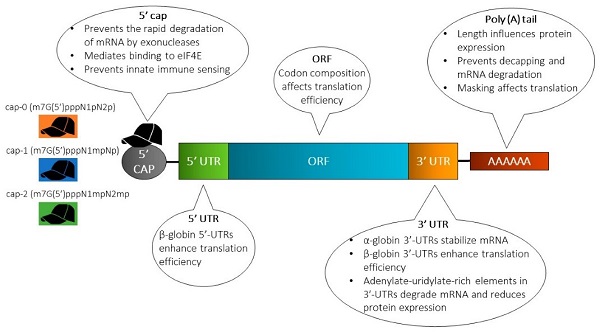
图2 mRNA结构[2]
mRNA分子本身不稳定,提高mRNA稳定性的技术包括优化5’Cap、调整3’Poly(A)尾长度以及修饰5’UTR和3’UTR中的调控元件。此外,将mRNA递送到细胞内部有两道屏障:递送途中的酶降解和静电排斥致使的膜屏障。需要特殊的修饰或递送系统才能实现mRNA的胞内表达。目前常用的mRNA递送系统如下:
脂质纳米粒LNP:是当前主流递送系统,采用此递送系统的公司有mRNA三巨头Moderna、BioNTech、 CureVac,此外还有Arcturus、 Valera LLC、 艾博、 珠海丽凡达、 深圳深信等
聚合物纳米粒PNP:代表公司为圣诺、达冕
脂质多聚复合物LPP:代表公司为斯微
GalNac:代表公司为苏州瑞博
阳离子脂质复合物LPX:代表公司为艾博、BioNTech
此外还有电穿孔EP、无机纳米粒INP、阳离子纳米乳CNE等
简单介绍一下LNP递送系统,LNP与mRNA形成脂质纳米颗粒,主要由以下五部分构成:
mRNA:有效成分
可电离阳离子脂质:与带负电的mRNA结合,可高效包载核酸药物,具有pH敏感性,生理条件下(pH=7.4)不电离,酸性条件下(≤5.0)发生电离,是mRNA递送和转染效率的决定性因素
中性辅助脂质:可提高阳离子脂质体的相变温度,支持层状脂质双层结构的形成并稳定其结构排列
胆固醇:稳定纳米粒结构,有较强的膜融合性,促进mRNA进入胞质
PEG修饰脂质:位于脂质纳米粒表面,改善其亲水性,避免被免疫系统快速清除(延长半衰期),防止颗粒聚集,增加稳定性
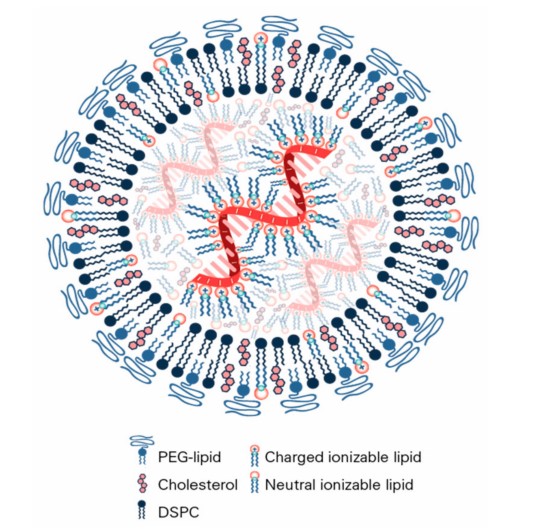
图3 LNP-mRNA结构(来源于Vaccines)
mRNA疫苗的作用原理:注射的mRNA疫苗被抗原呈递细胞内吞,在逃离胞内体进入胞浆后,mRNA被核糖体翻译成蛋白质,翻译后的蛋白可以通过多种方式刺激免疫系统,激起人体的细胞免疫和体液免疫。
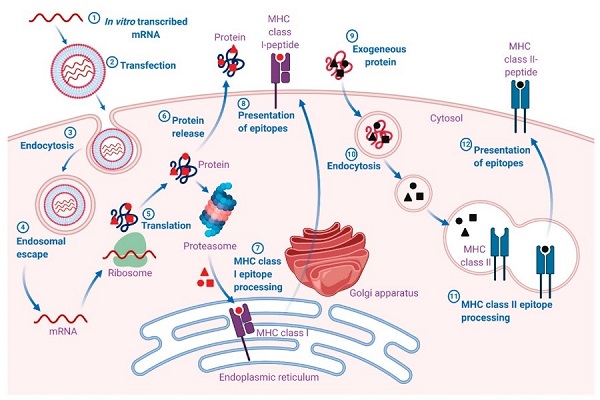
图4 mRNA疫苗作用原理[2]
本篇接下来重点从mRNA的技术特点、mRNA技术的应用领域、mRNA技术的优势与改进空间三个方面详细介绍。
一、mRNA技术特点
1.1.安全性高
mRNA疫苗没有减毒活疫苗"毒力返祖"或在部分个体中诱发严重疾病的可能。与DNA疫苗和某些病毒载体疫苗相比,mRNA疫苗不会整合到接种人群DNA中引发插入突变风险。
1.2.研发周期短
新冠疫情在全球的大流行突显了疫苗技术快速应用于人体试验的重要性和紧迫性。相对于传统疫苗的开发周期,目前获批的两款mRNA新冠疫苗的开发时间缩短了11个月到几年不等。
1.3.规模化生产效率高
由于mRNA疫苗体内发挥作用不依赖活病毒,因此无需专门的实验设备与生物安全实验室。在生产过程中,无需培养活的细胞,不存在细菌污染的风险。组成mRNA疫苗的基本化学成分相同,因此,建立了一条mRNA疫苗生产线后,可以对新出现的或季节性的流行病做出快速反应。
1.4.快速的抗原特异性序列优化
mRNA技术的另一项优势在于可以通过改变核酸序列来不断优化编码抗原,相对于制备不同蛋白或多肽的生物工程技术,这一过程相对更加简单直接。
1.5.可以编码多种蛋白或蛋白亚基
对于免疫原由多个不同亚基组成的病原体,生产多个亚基并按照化学计量学组成,成功的完成重组并构成完整蛋白的免疫原,其中的挑战不言而喻。而mRNA可以轻松地完成上述步骤。
1.6.调节mRNA免疫原性
除了通过改变mRNA序列优化抗原免疫原性之外,mRNA本身以及在mRNA制造过程中的其他RNA产物的固有免疫都可以用于增强免疫应答。目前,调节mRNA免疫原性主要的方法是核苷酸化学修饰。
1.7.递送mRNA的纳米制剂
目前,绝大多数mRNA药物都采用LNPs递送。LNP制剂的组成可显著影响胞内递送效率,决定递送靶细胞的特异性并调控免疫原性。
1.8.贮藏与运输
以冻干粉的形式贮存和运输是mRNA药物最常使用的方法。然而,在冻干过程中由结晶和真空脱水产生的应力可能会降低生物大分子或LNPs的稳定性,导致活性丧失。有报道指出,向制剂中加入某些冷冻保护剂(如海藻糖、蔗糖和甘露醇)可以维持特定处方的稳定性。
1.9.给药方式
尽管目前获批的新冠mRNA疫苗都选择肌内注射,关于mRNA疫苗的最佳接种途径还没有达成共识。目前,BTN162b2、CVnCoV、ARCT021和mRNA-1273都选择肌内注射;而来自伦敦帝国理工学院的研究人员则考虑通过吸入给药实现mRNA疫苗的自我扩增。吸入或鼻滴疫苗可引发细胞和体液免疫,这种方式对包括新冠病毒在内的呼吸道传染病防治中特别有效。然而,鼻腔内mRNA疫苗的研究目前仍停留在动物模型阶段。总的来说,肌内接种仍是各种疾病mRNA疫苗最常用的给药方式。
1.10.给药方案
对于新冠疫情的全球防治而言,最理想的给药方案是单次给药,但当下还没有达到这种程度。目前采取的策略是加强免疫,即间隔数周内接受至少2次注射。
1.11. mRNA疫苗的副作用
由于疫苗本身预防性、非治疗性的特性,对传染病疫苗需要较高的安全性与耐受性标准。疫苗局部注射疼痛、局部或全身炎症(发热、不适)是接种疫苗后最常见的不良反应。
二、mRNA的三大应用领域
mRNA理论上能够表达任何蛋白质,mRNA技术的应用领域非常广泛,目前能够应用的场景包括预防性mRNA疫苗,抗肿瘤mRNA疫苗及基于mRNA的蛋白免疫疗法与细胞免疫疗法。
1、预防性mRNA疫苗
mRNA新冠疫苗验证了mRNA技术平台在疫苗领域的适用性,BioNtech和Moderna研发的mRNA疫苗在真实世界中表现出了良好的安全性和较高的有效率,三期临床试验数据的有效性达到95%左右。两款mRNA新冠疫苗正式获批意味着传染病防治方面的划时代进步,接下来需要在其它传染性疾病的防治方面做出验证,图5列举了部分针对其他传染病的mRNA疫苗管线:
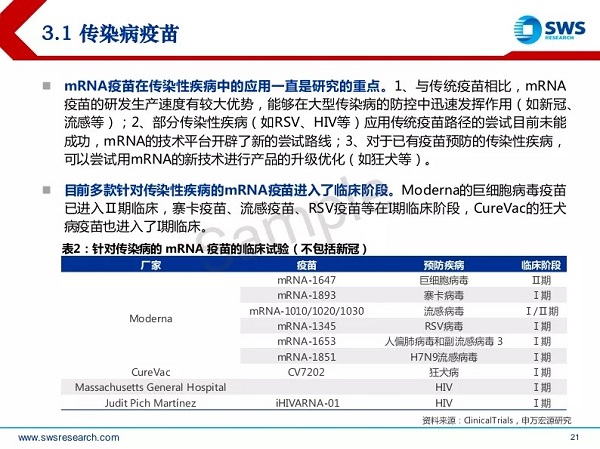
图5 针对其他传染病的mRNA疫苗管线(来源于ClinicalTrials)
2、抗肿瘤mRNA疫苗
将mRNA用于肿瘤免疫疗法的原理是利用mRNA编码突变肿瘤抑制蛋白,修饰肿瘤微环境,从而实现治疗目的。该方法的应用受限于mRNA递送技术。按照目前的递送能力,mRNA无法到达患者体内的每一个肿瘤细胞。因此,研发人员越来越关注将mRNA作为治疗性疫苗,诱导免疫系统识别并杀伤肿瘤细胞。
治疗性疫苗的开发过程有一系列常见的挑战。首先,传染病疫苗通过诱导机体体液免疫实现预防功能,而治疗性肿瘤疫苗还必须能够诱导强烈的CD8+T细胞反应以彻底根除所有肿瘤细胞。其次,开发肿瘤治疗性mRNA疫苗需要在体内编码能够诱导肿瘤高度特异性免疫反应的抗原。由于个体间抗原存在高度变异性,研究人员开发了一系列患者特异性的新抗原以应对这一挑战。最后,即便抗原能够诱导细胞免疫反应,抑制性肿瘤微环境可阻碍T细胞浸润肿瘤组织,甚至可能导致T细胞衰竭,因此治疗性疫苗还需要与克服抑制性肿瘤微环境药物(如免疫检查点抑制剂)联合使用。
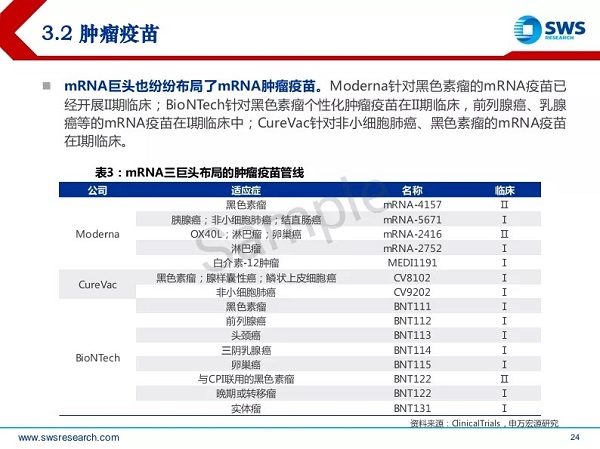
图6 mRNA三巨头布局的肿瘤疫苗管线(来源于ClinicalTrials)
3、蛋白免疫疗法与细胞免疫疗法
mRNA的一个新兴领域是体内编码可用于治疗的免疫蛋白或免疫调节蛋白,如抗体与细胞因子。与传染病疫苗、肿瘤疫苗相比,这些疗法需要产生更多的蛋白才可发挥作用,某些疾病甚至需要终身服药。
蛋白免疫疗法的一大挑战是将mRNA递送到所有目标器官和细胞中,实现最佳的治疗效果。当mRNA以LNP为载体全身给药时,由于载脂蛋白E可结合至LNP表面,LNP复合物将倾向于分布到肝脏组织,肝细胞表面受体将诱导LNP颗粒的肝细胞摄取。通过调整LNP中脂质成分(包括调整脂质比例和组成)可实现非肝脏的特异性组织分布,如肺组织内皮细胞或脾脏的靶向递送。
因此,与疫苗相比,mRNA蛋白免疫疗法在制剂递送、蛋白生产有效性和耐受性方面提出了新的挑战。这也可能是mRNA治疗药物比mRNA疫苗开发进度慢的原因。
3.1.mRNA编码单抗疗法
mRNA编码直接在胞内产生抗体吸引了很多关注。例如,CureVac正和Cenmab合作开展一项基于mRNA的mAb抗肿瘤疗法。
3.2.mRNA编码免疫刺激蛋白
另一种抗肿瘤的方法是注射可编码具有直接治疗效果蛋白的mRNA,编码蛋白通过刺激免疫系统实现肿瘤杀伤作用。
3.3.过继免疫细胞疗法中的mRNA
过继性免疫疗法是一种相对较新的治疗方法,这种方法从患者体内采集自身免疫细胞,体外处理后回输到患者体内,达到治疗肿瘤的目的。有研究表明,在乳腺癌瘤内注射转染了编码靶向c-Met的嵌合抗原受体(CAR)mRNA的T细胞,耐受性良好,可以在肿瘤组织中诱发免疫反应。
纳米制剂帮助mRNA递送至不同的免疫细胞,如巨噬细胞、B细胞和T细胞等,进一步扩大了免疫疗法的应用前景。例如, T细胞靶向递送mRNA技术为体内生成CAR-T细胞创造了可能性,开辟了肿瘤治疗的新方式。
三、mRNA技术的优势与改进空间
1、优势
mRNA在基因疗法和蛋白疗法中占据了独特的地位,结合了两种疗法的优势,又规避了二者面临的挑战。例如,在生物反应器中生产多聚体蛋白难度很大,而这一挑战可以通过单个mRNA或多种mRNA编码蛋白不同亚基后,在患者体内自组装解决。
给药可重复、剂量可调整、给药间隔可选择的特性让mRNA技术具有和经典药物治疗一样的灵活性,使其成为一个可适应患者个体需求的选择。
通过对重组蛋白的研究,mRNA疗法的潜力将进一步扩大。例如,mRNA可编码Fc结构域与治疗结构域的融合蛋白,可有效延长蛋白质的体内半衰期。而更令人兴奋的是将mRNA用于细胞疗法。mRNA基因编辑的瞬时作用可以避免永久表达带来的不良反应。
2、改进空间
由于RNA可以通过TLR和RIG-1信号通路激活免疫系统,RNA的免疫刺激性对mRNA药物具有非常重要的意义。这种免疫刺激性的缺点在于可能引发某些mRNA药物的安全性与耐受性问题。越来越多的证据表明,mRNA药物最常见的副作用是某些炎症反应。例如,在肌内注射或皮下注射时会出现疼痛、红肿、酸胀的局部反应;在肌内注射或吸入药物时可能出现发热综合征或流感样反应。这些症状通常可以用抗炎药处理,例如类固醇给药,但同时可能会降低蛋白表达水平。怎样平衡炎症反应和蛋白表达水平是一个问题。
尽管在单次疫苗接种和用于治疗肿瘤等危及生命的应用场景下,短暂的炎症反应是可以接受的,但对于需要长期治疗的适应症,尤其是通过静脉注射的给药方式,选择具有良好耐受性和安全性的脂质和其他辅料至关重要。
除即刻耐受性外,脂质蓄积带来的长期问题也需要考虑。若mRNA编码的蛋白质半衰期较短,则需要缩短给药间隔以维持临床疗效所必须的蛋白表达量,这可能引发脂质在靶组织和非靶组织中的蓄积,带来健康风险。mRNA的处方工艺将与mRNA生物学一道成为未来研发的重点。
mRNA的给药途径也很有想象空间,如肌内给药、皮内给药、皮下给药、淋巴结注射、瘤内注射、静脉注射、吸入给药、鼻内疫苗、滴眼液或滴鼻液等。未来mRNA的治疗领域将直接取决于纳米药物递送技术的进步。越来越多的证据表明,LNP和PNP可以实现机体组织靶向。而通过对递送材料的改进以及其他功能性材料的修饰,提高递送系统的靶向性与递送能力,mRNA的应用场景将进一步拓宽。
mRNA技术在新冠疫苗当中的使用还暴露了另一个问题:对冷链贮存与运输的依赖。以Biotech的mRNA疫苗为例,其需要在-80℃贮存与运输,不是所有药房和临床试验基地都具备这样的条件,对于患者在家中自行给药就更加不可能普及。因此,提高mRNA药物的稳定性对于扩大mRNA技术的应用领域至关重要。
参考资料:
[1]Ann J. Barbier et al. The clinical progress of mRNA vaccines and immunotherapies. Nature Biotechnology. 2022.
[2]Pharmaceutics 2020, 12(2), 102;