
资讯中心
作者:香雪生命科学-李柳萍
发布时间:2022-05-31
阅读:10150
在过去的几十年中,以质谱(MS)为基础的蛋白质组学已经成为鉴定蛋白质-蛋白质相互作用分析(PPIs)的重要技术。
作为生命活动的主要承担者,蛋白质的功能一直是科研活动中备受关注的明星。蛋白质通常不是“单打独斗”的,绝大多数的功能蛋白质通过与其它蛋白质或化合物相互作用,形成大分子化合物,从而发挥生物学功能。迄今已经发展出了多种用于研究蛋白质相互作用的技术和方法,例如免疫共沉淀,Pull Down,双分子荧光互补技术等。
1、免疫共沉淀
免疫共沉淀(CO-Immunoprecipitation,CO-IP)基于抗原与抗体的专一性结合的实验方法。简单来说,就是抗原与抗体是锁与钥匙之间的关系,一把钥匙(抗体)只能开一把锁(抗原),而钥匙(抗体)可以通过钥匙链(细菌蛋白的“protein A/G)快速找到。利用抗原A与蛋白B结合,通过A的抗体(钥匙)沉淀A(锁),再利用精制的protein A/G(钥匙链)预先结合到磁珠上,使之与含有抗原的溶液及抗体反应后,磁珠上的protein A/G就能吸附抗原,从而获得抗原A与蛋白B的复合体,之后就可以对B进行检测,从而获得蛋白质与蛋白质相互作用的信息。CO-IP是广泛应用于检测生理条件下蛋白质与蛋白质之间的相互作用的经典方法。
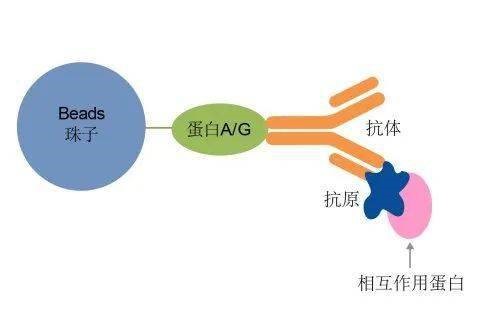
CO-IP原理示意图
通常情况下,若实验前已经对这些可能的互作蛋白有了猜测,可以将大颗粒物拖拽下来的蛋白复合体进行SDS-PAGE。再用 western-blot 的方法,用这些可能的互作蛋白的抗体去进行检测,就能验证这种蛋白质之间的相互作用了。
若想找一些以前未被报道,无法猜测的互作蛋白呢?这个时候,可以把免疫共沉淀后得到的样品,做蛋白组学,通过质谱对这个复合体中的所有成员进行鉴定,理论上你就获得了整个目标蛋白复合体的成员信息。
2、Pull Down
Pull-down技术用固相化的、已标记的饵蛋白或标签蛋白(生物素-、PolyHis-或GST-),从细胞裂解液中钓出与之相互作用的蛋白。通过Pull-down技术可以确定已知的蛋白与钓出蛋白或已纯化的相关蛋白间的相互作用关系,从体外转路或翻译体系中检测出蛋白相互作用关系。
Pull-Down的概念与CO-IP类似,其目的是研究与已知诱饵蛋白结合的蛋白或配体。Pull-Down旨在证明两种蛋白质之间的相互作用或探索可与目的蛋白结合的未知蛋白或分子。Pull-Down不同于IP或CO-IP之处在于,它不是基于抗体-抗原相互作用,不是免疫反应。CO-IP检测到的蛋白互作关系可能是第三个蛋白作为桥梁建立的,与之相比,pull down技术可用于检测蛋白之间的直接互作关系。但pull down需要先把诱饵蛋白原核表达纯化出来,再与目的蛋白溶液孵育,其无法像CO-IP一样模拟细胞内天然的互作环境。
GST pull down(GST融合蛋白沉降技术)是体外检测蛋白相互作用的常用方法,1988年Smith等利用谷胱甘肽-S-转移酶(GST)融合标签从细菌中一步纯化出GST融合蛋白,从此GST融合蛋白在蛋白质相互作用研究领域里得到了极大的推广。
GST Pull-Down实验基于GST(glutathione-S-transferase),即谷胱甘肽-S-转移酶蛋白,可以与谷胱甘肽(Glutathione,GSH)结合。将GSH固定于琼脂糖珠上,形成GSH-琼脂糖珠,将已知蛋白X与GST融合表达,获得的GST-X可与GSH-琼脂糖珠结合,若环境中存在与X蛋白互做的蛋白Y,则会形成“琼脂糖珠-GSH-GST-X-Y”复合物,与X蛋白互做的蛋白即可被分离并检测。
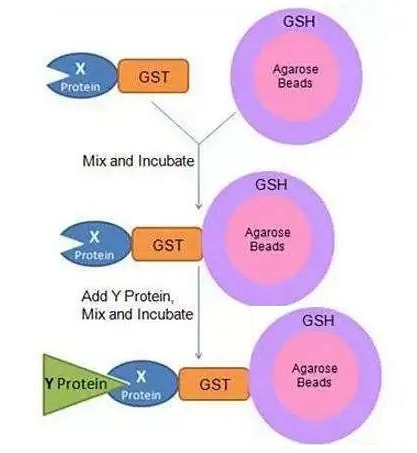
GST-Pull-Down原理示意图
一般来说,GST融合蛋白pull down方法用于两个方面:一是鉴定能与已知融合蛋白相互作用的未知蛋白质;二是鉴定两个已知蛋白质之间是否存在相互作用。
除了GST以外,类似的融合蛋白很多,如与葡萄球菌蛋白A融合的“诱饵”蛋白可以通过固定有IgG的色谱柱进行纯化;与寡聚组氨酸肽段融合的“诱饵”蛋白可以通过结合Ni2+ 的色谱柱进行纯化;与二氢叶酸还原酶融合的“诱饵”蛋白可以通过固定有氨甲蝶呤的色谱柱进行纯化等等。
3、双分子荧光互补技术
双分子荧光互补技术BiFC(Bimolecular Fluorescence Complementation),该技术是利用荧光蛋白的特点来研究蛋白的相互作用。将荧光报告蛋白按照规则分成没有荧光的两段N-fragment及C-fragment,分别与诱饵蛋白和捕获蛋白融合,只有在诱饵蛋白和捕获蛋白发生相互作用的情况下,两段不完整的荧光报告蛋白才会形成完整的报告蛋白,发出荧光。活细胞收集后,在流式细胞仪中的检测是实时进行的,只要细胞中有荧光产生就会被捕捉到信号,因此,不论是亲和力较弱的结合还是暂时性的结合都不会被遗漏。可视化是 BiFC 技术最大的特点。
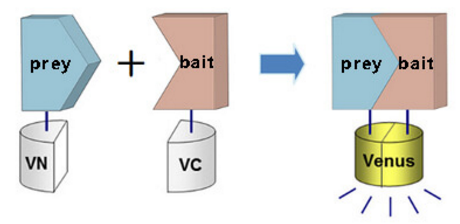
BiFC原理示意图
BiFC在沿袭蛋白质片段互补技术的基础上进行了优化,蛋白质互补技术中功能蛋白的活性由底物反应所体现,通过检测底物变化来判断蛋白质的相互作用,而BiFC技术则是利用荧光蛋白本身能够自我催化形成荧光活性中心并产生荧光蛋白的特征光谱的特点,直接反映蛋白质之间的相互作用,技术过程更加简单,结果更加直观。
目前常用于BiFC系统的荧光蛋白有GFP(green fluorescent protein,绿色荧光蛋白)、YFP(yellow fluorescent protein,黄色荧光蛋白)、CFP(cyan fluorescent protein,青色荧光蛋白)、BFP(blue fluorescent protein,蓝色荧光蛋白)、RFP(red fluorescent protein,红色荧光蛋白)、Venus、citrine、cerulean、mCherry等。Venus是目前最常用于BiFC分析的荧光蛋白,因为其荧光强,背景敏感度低,是BiFC系统理想的荧光蛋白。
研究蛋白质相互作用是BiFC系统最主要应用,迄今各种BiFC系统已经被成功用于多种蛋白质的相互作用,例如体外、病毒、大肠杆菌、酵母细胞、丝状真菌、哺乳动物细胞、植物细胞、甚至个体水平的蛋白质之间相互作用研究。除了能够验证蛋白质之间是否存在相互作用,BiFC系统还能够对细胞内蛋白相互作用位置进行研究。
BiFC也可用于药物开发,首先选取疾病相关的重要蛋白,基于BiFC技术开发BiFC稳转细胞株,不同的药物处理后检测荧光信号就可筛选潜在的治疗药物,具有良好的应用前景。