
资讯中心
作者:香雪生命科学研究中心--吴万里(翻译转载)
发布时间:2019-01-15
阅读:14205
TCR表达在T细胞的表面,由两条不同的蛋白链组成。在大多数成熟T细胞中,TCR由α和β链组成,在一小部分T细胞中,其TCR由γ和δ链组成。αβ-TCR的抗原识别在适应性免疫系统功能中占主导地位,αβ-TCR与抗原提呈细胞表面的“抗原肽-主要组织相容性复合物”(pMHC)结合。由于T细胞能够区分外源性pMHC与自身pMHC,因此αβ-TCR与pMHC之间的相互作用具有高度的特异性。CD8+ T细胞在肿瘤患者的适应性免疫应答中起着重要的作用,并通过TCR对特异性肽表位的识别而被激活,这些肽表位主要来源于内源性蛋白,由肿瘤细胞表面的MHCⅠ类分子所递呈。MHCⅠ类分子是在几乎所有有核细胞上表达的一种膜蛋白,它们由多个人类白细胞抗原(HLA)的基因(HLA-A、B、C等)所编码。HLA基因的表达可被干扰素(IFN)信号上调,但其在肿瘤中的表达往往被明显地下调,下调程度与癌症患者的免疫逃逸和疾病进展相关。T细胞活化需要pMHC抗原与TCR的结合,然后进入细胞内信号通路。体内外研究表明,递呈抗原的数量决定了T细胞中细胞因子的表达情况。
Naive T细胞经TCR/pMHC相互作用激活后,通过10~20轮的细胞分裂完成其克隆性扩增。相比于Naive T细胞,抗原刺激的T细胞通过一种叫做“功能性亲和力成熟”的过程将其抗原应答性大大提高。研究发现,抗原刺激的T细胞比naive T细胞具有更强的增殖能力和细胞因子生成能力。T细胞通过TCR-CD3群簇识别抗原-MHC复合物,在MHC和TCR相互作用后,多种蛋白被激活了的受体招募至质膜上并参与信号的传导(图2)。磷脂酶C-γ1(PLC-γ1)将膜磷脂酰肌醇二磷酸(PIP2)酶解成三磷酸肌醇(IP3)和二酰基甘油(DAG)。IP3与其内质网上的受体相互作用上调胞浆中Ca2+水平,激活Ca2+结合的钙调蛋白,随后调节活化T细胞核因子(NFAT)蛋白。此外,DAG还激活RAS/胞外调节激酶(ERK)通路,调节核因子Fos。通过这些相互作用的信号通路,T细胞被激活,释放出大量的细胞因子和趋化因子,包括γ-干扰素、颗粒酶B和IL-2。
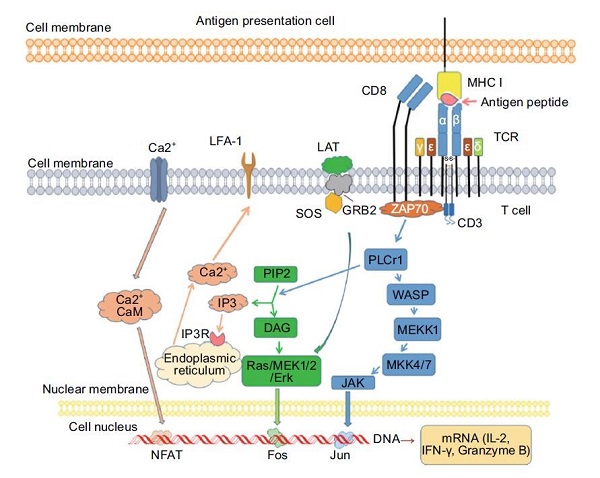
T淋巴细胞的功能主要受TCR信号的调控。研究表明,来自p38的初始TCR信号会相继触发维生素D受体(VDR)和PLC-γ1的诱导,这两者都是经典TCR信号传导和T细胞活化所必需的。基因阻断TCR的内化可以抑制T细胞的增殖,表明TCR信号是T细胞增殖所必需的。TCR的内化对于持续的信号传递和包括雷帕霉素靶标(mTOR)在内的关键代谢途径的激活也是必需的。T细胞失能是一种免疫耐受机制,其作用是控制T细胞的活化,当淋巴细胞遇到抗原后其内在功能失活,这种现象在肿瘤微环境中经常出现。通过“抗原诱导/肿瘤诱导失能模型"的研究发现,早期生长反应蛋白2(Egr2)是体内失能诱导时所必需的。因此,Egr2被认为是T细胞失能的重要转录调节因子。T细胞的活化状态和免疫应答水平进一步受多种共刺激因子(CD 28、诱导T细胞共刺激因子ICOS和OX 40)和共抑制因子(细胞毒性T淋巴细胞相关抗原CTLA-4、程序性死亡蛋白PD-1)的控制。例如,在免疫检查点PD-1缺失的情况下,融合抗体B7H1-Ig可以增强T细胞增殖和免疫应答。这表明,在基于B7H1介导的通路上干预、增强或下调免疫应答是可能的。
注:本文已获得原文[1]作者(Ping Y)就原文翻译以及网络刊登的授权。 [1] Ping Y, Liu C, Zhang Y. T-cell receptor-engineered T cells for cancer treatment: current status and future directions [J]. Protein Cell, 2018,