
资讯中心
作者:香雪生命科学-林世华
发布时间:2023-05-21
阅读:14538
近年来,癌症治疗发展迅速,免疫治疗已经成为仅次于手术、化疗和放疗的一种成熟的癌症治疗方法。免疫治疗作为一种新兴的治疗手段,主要是通过基因改造的手段提高T细胞对特异性癌症细胞抗原的识别能力和杀伤能力,然后再回输到人体来杀灭癌细胞。新抗原被认为是非自我的,并且触发的免疫反应不受中枢和外周耐受影响,因此,拥有肿瘤特异性和高度免疫原性的新抗原成为了免疫治疗的理想靶标。新抗原在正常组织中是不存在的,是肿瘤细胞由于各种肿瘤特异性改变(基因组,转录组和蛋白质组变异)而产生的新形成外源蛋白。
1.基因组变异
体细胞基因组的改变,包括单核苷酸突变(SNVs)、碱基插入和缺失(INDELs)和基因融合,是促进肿瘤新抗原产生的主要因素。
SNVs是肿瘤细胞基因组水平上最常见的突变类型,他们可以产生不同于野生型蛋白的突变肽并被MHC-I呈递。另外SNVs也可能出现在线粒体DNA (mtDNA)中,研究发现,mtDNA中的非同义的单核苷酸多态性(SNP)可以产生大量的突变肽并具有免疫原性,这些突变肽也是新抗原的来源之一。INDELs突变主要是由基因组中碱基对的插入或缺失引起,也称移码突变,经常导致出现非同义的新ORFs。移码INDELs可产生很多类型的新抗原,并且与MHC-I的结合亲和力增加,这意味着与SNVs相比,INDELs是具有更高的免疫原性突变类型。基因融合是肿瘤中另一种重要的突变类型,可以通过间充质缺失、染色体易位或染色体倒置产生许多新抗原。在一项关于肿瘤融合新抗原的综合研究中,通过对TCGA数据库的三个数据集的分析发现,融合突变可以产生很多的新的ORFs,产生的新抗原是SNVs和INDELs的6倍,特异性候选新抗原是SNVs和INDELs的11倍。融合新抗原与SNVs和INDELs产生的新抗原相比,更容易诱导更强的免疫反应,而移码融合产生的新抗原比框内融合新抗原具有更好的免疫原性。
2.转录组变异
mRNA的选择性加工、多聚腺苷酸化(pA)、RNA编辑和所谓的非编码性为肿瘤特异性新抗原提供多样性。
肿瘤中异常的mRNA选择性加工是肿瘤特异性新抗原的另一个潜在来源,主要包括顺式作用突变、剪接因子的反式作用力改变和无义介导的RNA衰变(NMD)。顺式作用元件突变主要包括5’和3’端可变剪接位点的确定,内含子保留、外显子跳跃和相互排斥的外显子,有研究发现,在肿瘤中独有的外显子-外显子连接,通过翻译,这类连接大多数都可以表达新的抗原。反式作用力改变是剪接因子的体细胞突变导致剪接变体的改变,诱发整个基因组新抗原的产生。NMD调控机制由于在肿瘤细胞中经常受损,使异常的转录本避免了降解,导致新抗原产生。总之,这些mRNA的可变加工异常导致衍生出了许多异常多肽,促进了新抗原的产生。
与RNA剪接类似,聚腺苷酸化(pA)和RNA编辑可以改变肿瘤细胞的蛋白质组学特征,从而增加潜在的免疫治疗靶点。大多数选择性多聚腺苷酸化(APA)发生在mRNA的3’非翻译区。而一些APA事件发生在最后一个外显子上游的内含子区域,这些被称为内含子多聚腺苷酸化(IPA)。IPA可导致截短或非编码转录本的产生,这些转录本有可能成为肿瘤特异性免疫治疗的靶点。RNA编辑是一种重要的前mRNA处理方法,它可以通过改变RNA序列中的特定核苷酸来诱导非同义替换,从而产生新的蛋白质。另外,一些以前被定义为非编码的区域现在被发现具有编码功能,通过研究这些新定义的具有编码能力的基因可以由MHC-I递呈的抗原肽,其中一些抗原已经被确定为TIL免疫治疗的靶标。
3.蛋白质组变异
翻译失调是肿瘤发生的一个特征,它为肿瘤特异性新抗原提供了一个重要的新来源。蛋白质组学的变异还来自于翻译后修饰(PTMs)、蛋白酶体加工和抗原加工相关转运体(TAP)的功能异常。
异常的PTMs,包括糖基化、O-连接的β-n-乙酰葡萄糖胺(o-GlcNAc)和磷酸化,可以在肿瘤中产生由MHC复合物递呈的新抗原肽。大比例的突变可能会增加新的n-糖基化位点的形成,异常的磷酸化可通过促进表位与MHC分子结合或通过改变呈递表位的抗原特征,这两个异常都会导致新抗原的产生。大多数肿瘤抗原需要蛋白酶体加工和TAP介导肽的转运。然而,大多数肿瘤最终会获得抗药性和免疫逃逸。据报道称,肿瘤可以通过产生缺陷的HLA-I抗原处理途径或下调相关基因的表达来避免被T细胞识别。科学家们在一些HLA-I低/TAP缺陷的肿瘤中发现了一类新的抗原,称为与受损的多肽加工相关的T细胞表位(TEIPP)。TEIPP可以激活特异的CD8+T细胞,并杀死这些TAP缺陷的癌细胞,是一类来自肿瘤自身管家蛋白的未突变抗原。
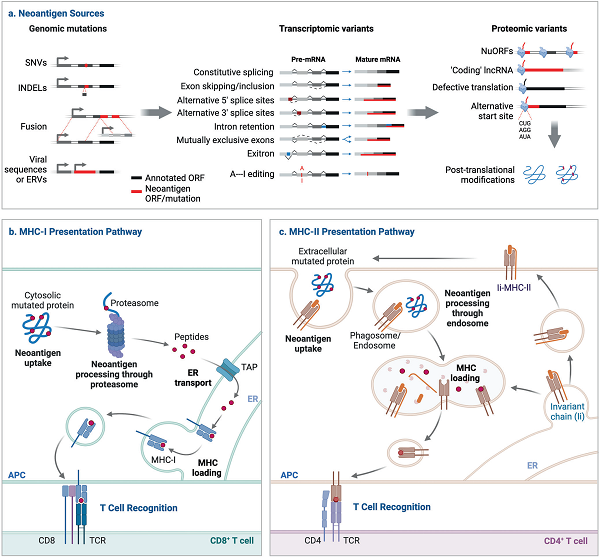
新抗原的产生是基因组、转录组和蛋白质组水平改变的结果。目前的研究主要集中在SNVs和INDELs,他们是肿瘤细胞中最常见的基因组水平突变类型。然而,由SNVs和INDELs产生的新抗原的临床应用受到了其患者特异性和较差的免疫原性的限制,导致对癌症患者的临床获益较少。越来越多的证据表明,肿瘤新抗原的其他来源,如基因融合、选择性剪接变体和PTMs,可能是较有吸引力的免疫治疗新靶点。基因融合产生的新抗原,尤其是移码融合产生的新抗原,具有更好的免疫原性,且已被纳入许多临床试验。此外,由基因融合、癌症驱动基因的复发性突变、非编码区和异常PTMs产生的新抗原更有可能在患者之间共享,从而为免疫治疗提供现成的公共新抗原。综上所述,充分研究利用新抗原可为癌症细胞治疗提供更广阔的应用前景,使之成为一种更加持续且有效的治疗方法。
参考文献:Xie N , Shen G , Gao W , et al. Neoantigens: promising targets for cancer therapy[J]. Signal Transduction and Targeted Therapy.