
资讯中心
作者:香雪精准医疗--唐先青
发布时间:2020-04-02
阅读:14835
摘要:由新型冠状病毒(SARS- CoV-2)引起的冠状病毒疾病19(COVID-19)正在全球203国家和地区爆发和持续蔓延。COVID-19超强的传染性和高的死亡率使得本次抗疫就犹如一场没有硝烟的世界大战。它的传染性高是因为SARS- CoV-2的潜伏期较长(2-14天),并且在早期无症状或者轻症时便可以人际传播。它的致死原因则是由于它能引起人体细胞因子释放风暴(CRS),进而导致急性呼吸窘迫综合症(ARDS),产生严重的肺部器官衰竭而死亡。本文将对比SARS-CoV和MERS-CoV的一些研究数据,来理解SARS-CoV-2的宿主病理反应、免疫应答、细胞因子风暴,及应对策略。
关键词:严重急性呼吸综合症冠状病毒2(SARS-CoV-2),冠状病毒疾病19(COVID-19),细胞因子释放风暴(CRS),急性呼吸窘迫综合症(ARDS)
介绍:
从2019年12初开始,在湖北的省会武汉市首先爆发了不明原因肺炎。2020年1月7日中国科学家从病毒感染者体内分离得到了一种新型冠状病毒(命名为SARS-CoV-2,早期名称为2019-nCoV)。随后在2月份,WHO正式将由新型冠状病毒引起的肺炎命名为冠状病毒疾病2019(COVID-19)。截至目前,COVID-19在全球多点爆发,并呈现蔓延扩大趋势,全世界确诊感染者已经高达63万人之多,死亡人数已经超过3万,全球死亡率在4.7%,其中意大利死亡率最高为10.8%,我国的死亡离在4.0%(数据来源于WHO官方网站2020年3月30日公布)。在2002-2003年爆发的严重急性呼吸综合症(SARS)的死亡率是9.14%(744/8096),2011年爆发的中东呼吸综合症(MERS)的死亡率是34.4%(858/2494),COVID-19的死亡率虽不及SARS和MERS,但是传染力都极大地超过了后二者[1]。
COVID-19病人的普遍临床症状为发烧、咳嗽、气短、疲倦或肌肉疼痛,老年人和有基础慢性病如高血压、心血管病和糖尿病等人群是新冠病毒感染的高危人群[2]。2020年2月17号,中国科学家Xu Zhe等人在《The Lancet》杂志上发表了对一位新冠病毒感染者的尸体活检报告文章,发现新COVID-19的病理特征与SARS和MERS冠状病毒感染极为相似,这类病毒的致死原因是引起病人肺泡损伤伴随大量细胞内黏液渗出,继而引发急性呼吸窘迫综合症(ARDS)[3]。ARDS的根本发病原因即细胞因子风暴(CRS):肺组织中的炎症反应失控,过度免疫反应使得大量的免疫细胞在肺中激活和募集,异常升高的细胞因子与过度激活的免疫细胞,造成肺毛细血管内皮细胞及肺泡上皮细胞弥漫性损伤,大量渗出液聚集阻塞气道,致使患者呼吸困难窒息而死[4]。本文将借助SARS-CoV和MERS-CoV的一些研究数据,来理解新型冠状病毒SARS-CoV-2在宿主体内的病理反应、免疫应答、细胞因子风暴,及应对建议。
SARS-CoV-2感染进入宿主机理
中国科学家率先从病人体内分离病毒并且对SARS-CoV-2进行了全基因组测序,发现它与2个蝙蝠来源的SARS类冠状病毒序列最相近(88%同源性),与SARS-CoV的同源性为79%和MERS-CoV的同源性为50%。更进一步,他们还通过同源建模发现SARS-CoV-2的Spike蛋白受体结合结构域(RBD)与SARS-CoV十分相似,这预示SARS-CoV-2也是用血管紧张素转换酶2(ACE2)作为融合的细胞受体[5],后续相关体外研究证实了这一推测[6](如图1)。有报道称还存在其它融合受体。
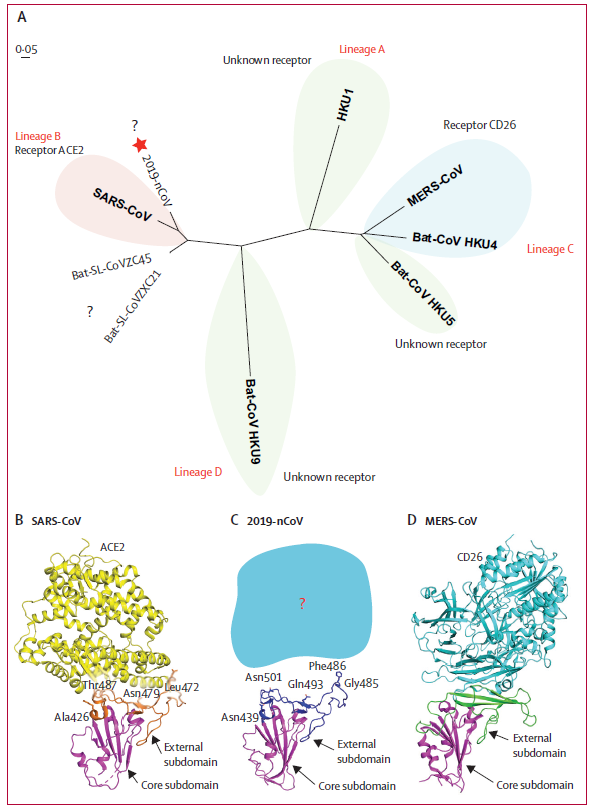
图1. 系统发育分析和同源建模展示SARS-CoV SARS-CoV-2 MERS-CoV的受体结合结构域
图片引自文章[5]
宿主对SARS-CoV-2的免疫应答
大多数病人都会发展为淋巴细胞减少症(Lymphopenia)和肺炎(Pneumonia),在胸部CT显示肺部毛玻璃样混浊变化。在COVID-19的重症病人体内,还发现了高水平的促炎因子,包括IL-2、IL-7、IL-10、G-CFS、IP-10、MCP-1、MIP-1A和TNFα[2],即细胞因子风暴,这些发现跟SARS和MERS极为一致,淋巴细胞减少和细胞因子风暴能引发病毒性败血症和炎症性肺损伤,进一步导致严重肺炎、急性呼吸窘迫综合症(ARDS)、休克、器官衰竭和死亡[1]。
先天性免疫应答:基于病毒基因组测序发现SARS-CoV-2和SARS-CoV有比较大的相似性(79%),可以推测SARS-CoV-2采用了相似的策略来调节宿主的先天性免疫应答,如图2. SARS-CoV-2通过ACE-2进入肺泡细胞或其它表达ACE-2的细胞(可能还存在其它受体),早期阶段病毒会抑制抗病毒IFN应答导致大量的病毒复制,进而涌入大量的中性粒细胞和单核/巨噬细胞导致促炎因子高表达,即形成细胞因子风暴,特异性的Th1/Th17被激活进一步加强炎症应答。[1]。
适应性免疫应答:体液免疫应答通过产生中和抗体,在感染后期限制了感染和阻止未来二次感染。体外研究发现,从5个病人体内的获得的血清(含有特异性抗体)可以中和SARS-CoV-2[7]。T细胞免疫应答通过诱导刺激CD8+和CD4+ T细胞活化,杀死被SARS-CoV-2感染的细胞。科学家对一例病人尸体活检发现其外周CD4+和CD8+ T细胞显著减少,但它们是高度活化的状态,这些过度活化的T细胞,包括增加的Th1/Th17和高细胞毒性的CD8+ T细胞导致了严重的免疫损伤[3]。
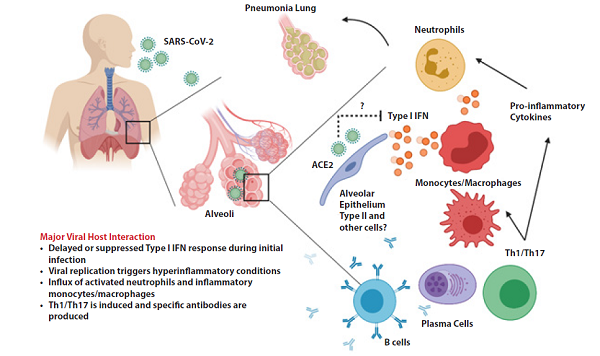
图2. 宿主对SARS-CoV-2的先天性免疫应答。
图片引自文章[1]
细胞因子风暴:冠状病毒真正的致命武器
细胞因子释放风暴(CRS),最早由Ferrara 等于1993 年在移植物抗宿主病(graft-versus-host disease, GVHD) 中提出,是机体对于病毒、细菌、纳米材料等外界刺激所产生的一种过度免疫。细胞因子风暴中,细胞因子与中性粒细胞、巨噬细胞之间通过特定的正反馈机制,使多种细胞因子在组织、器官中异常升高,最终导致单器官或多器官损伤、功能衰竭而死亡。
急性呼吸窘迫综合征(ARDS)是临床常见危重症,其发病急、病情重、治疗手段有限,病死率高达40%~70%。ARDS 的根本发病原因即CRS:肺组织中炎症反应失控,过度免疫反应使大量的免疫细胞在肺中激活、募集。异常升高的细胞因子与过度激活的免疫细胞,造成肺毛细血管内皮细胞以及肺泡上皮细胞弥漫性损伤,大量渗出液聚集使气道阻塞,临床表现为急性非心源性肺水肿和顽固性低氧血症(如图3)。细胞因子在病毒感染中具有重要作用。[4]
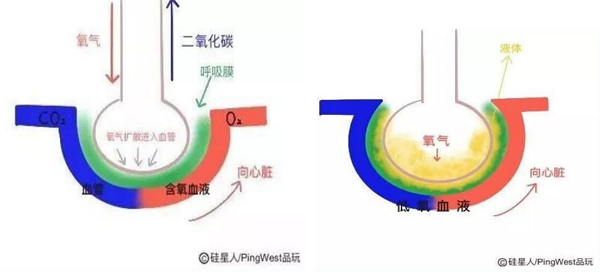
图3. 急性呼吸窘迫产生原理简图。
(图片来自http://blog.sina.com.cn/s/blog_af270f560102yyhw.html)
多数病毒感染所诱导的促炎细胞因子升高,可促进机体细胞对这些入侵病毒的清除。病毒成功清除后,促炎细胞因子在负向免疫调控网络,如Th2、Treg 等细胞及抗炎细胞因子的作用下,回归正常,疾病消退。然而,在某些情况下,病毒感染却导致机体免疫调控网络失衡,引起的细胞因子风暴导致疾病恶化。如在感染巨细胞病毒的IL10 基因敲除小鼠中,IL-6等促炎细胞因子的显著升高,虽然可以降低病毒载量,细胞因子风暴却导致疾病更加严重。在COVID-19的重症病人体内,发现了高水平的促炎因子,包括IL-2、IL-7、IL-10、G-CFS、IP-10、MCP-1、MIP-1A和TNFα,即细胞因子风暴[2]。很多病毒,如SARS 冠状病毒、2009 甲型H1N1 流感病毒、禽流感病毒,均可导致细胞因子风暴,其重症感染患者的血清中IL-17、IP-10、IL-6、KC、G-CSF、GM-CSF、MCP-1、MIG 等细胞因子的水平显著增高。细胞因子风暴在上述病毒导致的ARDS 中具有重要作用[4]。这些病毒感染后,机体产生免疫系统的应答,本意是要将病毒清除,结果却被病毒诱发产生了失控的过激反应,免疫调控网络失衡、负反馈的缺失和正反馈的不断自我放大,使得多种细胞因子异常升高,最终导致单或多器官损伤、功能衰竭而致死。非病毒本身,而是病毒劫持的机体自身免疫系统,其过度应答酝酿成细胞因子风暴,从而造成器官损伤,扼住了生命的咽喉。
应对细胞因子风暴的策略
靶向治疗细胞因子风暴中的特异细胞因子,应用其单克隆抗体以拮抗病理情况下的体液促炎因子来减轻细胞因子风暴,或应用特异重组蛋白调节细胞因子风暴,有希望减轻ARDS。例如,用托珠单抗(Tocilizuman)来封闭IL-6受体,以缓解COVID-19肺炎病人的细胞因子释放综合症,该临床试验已在中国批准开始[8]。
总结,SARS-CoV-2引发COVID-19,传染性比SARS和MERS强,通过ACE-2(或其它可能的融合受体)进入肺泡细胞(或其它细胞),快速失控复制并引起宿主免疫过度反应,产生细胞因子释放综合症(CRS),进一步导致严重肺炎、急性呼吸窘迫综合症(ARDS)、器官衰竭和严重者死亡。为应对细胞因子风暴可采用相应单抗重组蛋白进行靶向治疗,调节免疫系统平衡,减轻免疫系统过度激活对器官所带来的破坏,进而达到有效治疗的目的。
参考文献:
1. Prompetchara, E., C. Ketloy, and T. Palaga, Immune responses in COVID-19 and potential vaccines: Lessons learned from SARS and MERS epidemic. Asian Pac J Allergy Immunol, 2020. 38(1): p. 1-9.
2. Huang, C., et al., Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet, 2020. 395(10223): p. 497-506.
3. Xu, Z., et al., Pathological findings of COVID-19 associated with acute respiratory distress syndrome. Lancet Respir Med, 2020.
4. 张艳丽 and 蒋澄宇., 细胞因子风暴:急性呼吸窘迫综合征中的主宰生命之手. 生命科学, 2015. 27(5): p. 554-557.
5. Lu, R., et al., Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding. Lancet, 2020. 395(10224): p. 565-574.
6. Hoffmann, M., et al., SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell, 2020.
7. Zhou, P., et al., A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature, 2020. 579(7798): p. 270-273.
8. Mehta, P., et al., COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet, 2020.