
资讯中心
作者:香雪生命科学研究中心-郑文静
发布时间:2019-09-25
阅读:14203
肿瘤疫苗研发被《自然》杂志评为 2018 年生物医学技术重大突破之一,肿瘤疫苗已成为肿瘤免疫疗法的研究热点。
肿瘤疫苗是用经过处理的肿瘤细胞或肿瘤抗原来激活机体免疫系统产生特异性抗肿瘤细胞免疫反应的一种治疗性的、新型的肿瘤治疗方法。大多数肿瘤疫苗是被作为治疗性药物而不是预防性药物来研究。肿瘤疫苗可以设计成肿瘤细胞选择性表达的相关抗原,比如,生长相关因子,体细胞突变引起的恶性细胞特有抗原[1]等。
根据疫苗来源,肿瘤疫苗可分为肿瘤细胞疫苗、基因疫苗、多肽疫苗、树突状细胞疫苗等。其中,mRNA肿瘤疫苗在众多疫苗类型中脱颖而出,作为治疗性疫苗迅速得到广泛关注。mRNA肿瘤疫苗表达肿瘤相关抗原,激活细胞介导的特异性免疫反应,如典型的T淋巴细胞应答,清除或抑制肿瘤细胞。mRNA肿瘤疫苗作用机制如下,见图一[2]。
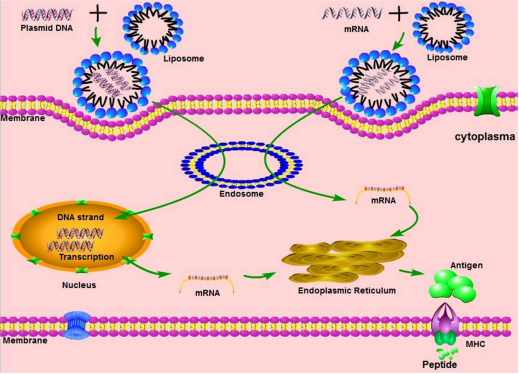
图一DNA(左)和mRNA(右)疫苗的作用机制[2]
相比于常规药物的研发与检测,mRNA的合成不仅简单快速,而且价格低廉。同时这种人为设计的核酸材料并不会诱发人体的免疫反应,更重要的是,表达后的mRNA随后便会自然降解,不会对人体产生毒副作用[3]。相比于传统疫苗和DNA 疫苗,mRNA疫苗具有如下优势:
“mRNA疫苗”VS“多肽疫苗”
更加容易产业化规模化生产,体外转录产生的mRNA,时间成本会大大降低,且不具有多肽疫苗不容易水解的工业化难题。
产生更强的免疫反应及长久的免疫记忆,mRNA编码的抗原决定簇不需要HLA分型,体内翻译成蛋白质并经修饰后,能诱导强烈的CD4+ 或 CD8+的T细胞应答。而多肽疫苗往往免疫原性低,需要结合佐剂来启动对抗肿瘤的免疫应答,这也是科学家们一直致力解决的难题。
易于表达多种肿瘤抗原,mRNA疫苗可以同时表达多个肿瘤抗原,这是目前多肽技术所不可比拟的。
“mRNA疫苗”VS“DNA 疫苗”与DNA 疫苗相比,mRNA疫苗的优势主要体现在有效性及安全性上,免疫原性高,效果好。DNA 疫苗必须跨过细胞膜和核膜,在细胞核内进行DNA整合后再进行转录,而mRNA疫苗不需进入核内发挥作用,因而技术难度上降低,效率提升。使用安全性高。mRNA疫苗不进入基因组, 不会引起突变,没有潜在的人类基因组整合风险。
基于这些显著的优势,mRNA肿瘤疫苗成为癌症治疗道路上的一股新秀,许多企业及科研结构都在进行相关的研究试验。然而,RNA也存在致命的缺点--稳定性差,裸露的mRNA直接进入体内时极易被降解,常常发生患者给药失败的问题。mRNA被翻译成肽段、然后被加工,表达的肿瘤抗原必须递呈到APC上的MHC I类和II类分子,这些过程均不容出错。从分子结构上,添加非编码区可以增强RNA的稳定性。这些虽然可以在给药前保护RNA不被降解,但RNA仍然可以在细胞内[4]及其细胞器内发生降解[5]。可喜的是,纳米递送系统被开发运用于此并已经证实为mRNA最有效的递送方式,并能保护mRNA前后免于降解[6,7]。
脂质体纳米颗粒,作为一种优秀的mRNA递送载体,它是由生物相容性材料组成,具有良好的生物安全性。通过化学方法改变脂质体纳米颗粒粒径、电荷比(负电位RNA与正电位脂质体)以及脂质体组成,可使纳米颗粒更有效地靶向淋巴器官。其他的翻译修饰剂(如DOPE、胆固醇、聚乙二醇)可增强脂质骨架的稳定性,从而增强其生物相容性以及脂质体纳米颗粒靶向肿瘤的EPR效应(实体瘤的高通透性和滞留效应)。RNA-脂质体目前处于人体临床试验阶段,已经有好的早期结果,这为肿瘤主动免疫治疗翻开了崭新的一页。
mRNA疫苗的给药途径对于mRNA疫苗的疗效影响很大。mRNA疫苗通常是系统或局部给药,直接肌肉注射(i.m.)、皮内(i.d.)或皮下注射体外转录的mRNA是mRNA肿瘤疫苗的主要给药途径。然而,当体系需要系统表达特定抗原时,为了治疗疗效也可采用腹腔注射(i.p.)和静脉(i.v.)给药。最近多篇文献报道,mRNA肿瘤疫苗经接种后可以高效表达多种抗原,并且可以诱导有效的体液和细胞免疫应答。例如,在研究负载有核苷修饰并编码荧光素酶的常规mRNA的脂质纳米颗粒(LNP)给药途径对抗原表达动力学的影响时,发现肌肉注射(i.m.)和皮内注射(i.d.)表现出了最佳的抗原水平和效果持续时间;根据剂量,蛋白质产量在4小时达到峰值,并可在注射后局部维持8-10天[8]。也有研究表明,通过树突细胞装载mRNA可以激发肿瘤抗原产生免疫应答,并且将树突细胞载mRNA疫苗与传统化疗药物或免疫检查点制剂联用都有希望取得惊人的临床效果。
尽管在抗癌道路上,mRNA肿瘤疫苗势头不小,但在相关临床试验中仍然存在着局部和全身炎症反应等问题。因此,mRNA肿瘤疫苗在用于人体或是开展大规模临床研究前,还要进行严格的生物安全性评价。后续会如何,让我们拭目以待。
参考文献:
1. Human tumor antigens and cancer immunotherapy. Biomed Res Int. 2015; 2015:948501.
2. Advances in mRNA Vaccines for Infectious Diseases. Front Immunol. 2019; 10: 594.
3. Cancer Vaccine Immunotherapy with RNA-Loaded Liposomes. Int. J. Mol. Sci. 2018, 19, 2890.
4. Degradation of mRNA in eukaryotes. Cell 1995, 81, 179–183.
5. Gene delivery by cationic lipids: In and out of an endosome. Biochem. Soc. Trans. 2007, 35, 68–71.
6. Lipid-based nanocarriers for RNA delivery. Curr. Pharm. Des. 2015, 21, 3140–3147
7. Lipid nanoparticle assisted mRNA delivery for potent cancer immunotherapy. Nano Lett. 2017, 17, 1326–1335.
8. Expression kinetics of nucleoside-modified mRNA delivered in lipid nanoparticles to mice by various routes. J Control Release. 2015; 217:345–51.