
资讯中心
作者:香雪生命科学研究中心-温桥生
发布时间:2019-08-27
阅读:15146
细胞是生命的单位,人体正是由数以万亿计的单细胞组成的复杂生命体,细胞经过分化而具有不同的功能,它们通过组成组织或者器官在人体中各司其职而又相辅相成,俨然一座巨大的高科技工厂,但总有极小部分“不安分”的细胞极力想从这个井然有序的体系中挣脱,它们通过“去分化”等一系列手段来获得自由身,回到一个类似“始祖”的状态,并获得无限增殖的能力,这就是肿瘤细胞。肿瘤细胞就像一个独立的单细胞生命体,在形成之初就开始通过分泌细胞因子等方式改变周围的微环境,并不断分裂增殖壮大自己的队伍,在这个时期,游走在身体里的各种免疫细胞,包括NK细胞、T淋巴细胞等就会及时发现并清除这些突变的“异类”,但是当免疫系统发生异常,免疫细胞没有及时发现它们,这些肿瘤细胞就会继续发展形成一个比较复杂的肿瘤组织,这时T淋巴细胞想要再把它们清除干净就变得有心无力,肿瘤也就发生了。
肿瘤之所以能逃避免疫系统的识别清除,一方面是因为免疫系统自身出了问题,导致免疫细胞无法正常识别杀灭肿瘤细胞,比如,获得性免疫缺陷综合症(艾滋病)患者,由于体内CD4+T淋巴细胞急剧减少,导致免疫系统严重受损,患者往往会死于肿瘤或其它感染,另一方面是因为肿瘤细胞相当的“聪明”,它可以通过多种途径主动逃避免疫系统的监视,例如:1、通过下调MHCⅠ类分子、非特异性物质封闭细胞表面抗原、下调抗原加工提呈相关分子等手段,使肿瘤细胞缺乏刺激机体发生免疫应答所必须的成分;2、肿瘤细胞在机体内长期存在,其抗原可在淋巴细胞分化成熟过程中,尤其是处于幼稚阶段的淋巴细胞发生作用,从而诱发机体产生免疫耐受;3、肿瘤细胞可通过调节自身表达的分子,如高表达抗凋亡因子、不表达Fas及Fas信号转导通路相关分子等方式逃避肿瘤特异性CTL的杀伤,还可以通过分泌多种细胞因子,作用于肿瘤微环境中的免疫细胞,改变它们正常的生理功能,这其中就包括了我们接下来要讨论的主角-巨噬细胞。
巨噬细胞是固有免疫的重要组成成分,由血液中的单核细胞穿出血管进入各组织器官发育成熟而来,巨噬细胞因所处部位不同而具有不同的形态和名称,如在肝脏中的巨噬细胞叫库普弗细胞(Kupffer cell),它们的功能也不尽相同,但都具有重要的生理功能,概括起来主要包括以下几点:1、识别、清除病原体等抗原性异物;2、参与和促进炎症反应;3、对肿瘤和病毒感染细胞等靶细胞的杀伤作用;4、加工提呈抗原,启动特异性免疫应答;5、免疫调节作用等。但巨噬细胞也并非总是扮演正面的角色,巨噬细胞也可能会被肿瘤细胞“带坏”,变成“助纣为虐”的肿瘤相关巨噬细胞(Tumor-associated macrophages,TAMs)。
肿瘤相关巨噬细胞(TAMs)是瘤体内含量最丰富的免疫相关细胞,是构成肿瘤微环境的关键承担者,直接影响肿瘤的生长、血管形成以及胞外基质重建等。肿瘤相关巨噬细胞是由单核细胞在肿瘤组织中训导分化形成的,单核细胞游走出血管进入肿瘤组织形成肿瘤相关巨噬细胞,根据其活化方式不同,可以分为经典途径活化的巨噬细胞(classically activated macrophage,M1)和替代途径活化的巨噬细胞(alternatively activated macrophage,M2)。两种活化途径的巨噬细胞在免疫表型及生理功能上表现迥异。前者主要分泌促炎性细胞因子,表现出较强的抗原呈递及诱导免疫应答能力从而发挥杀伤细菌及肿瘤细胞;而后者主要分泌抑制免疫的细胞因子,表现为较弱的抗原呈递能力,具有促进伤口愈合及血管形成等组织修复作用。在侵袭能力较强的乳腺癌,如三阴性乳腺癌中,浸润的肿瘤相关巨噬细胞通常为M2型。
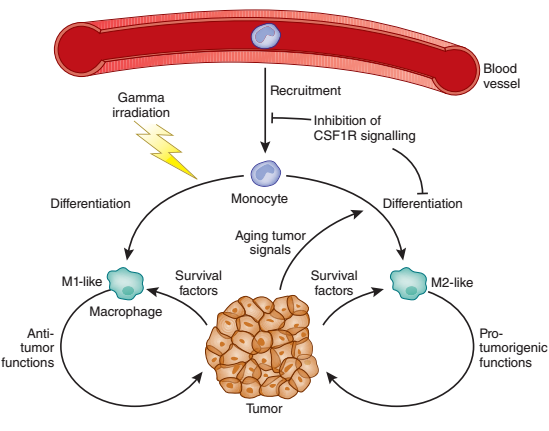
图片来自:Vincenzo Bronte et al. 《NATURE MEDICINE》2015
根据以往的研究证据表明M2型肿瘤相关巨噬细胞可主要通过两种机制促进肿瘤细胞侵袭和脉管内渗。第一种机制是巨噬细胞通过双向旁分泌信号辅助肿瘤细胞向血管迁移,称为巨噬细胞-肿瘤细胞反馈回路。如TAMs表达单核细胞集落刺激因子受体(M-CSFR,也称为CSF-1R或cFMS),其结合由肿瘤细胞分泌的单核细胞集落刺激因子(M-CSF,也称为CSF-1),被刺激的TAMs分泌表皮生长因子(EGF)并激活肿瘤细胞上的EGF受体(EGFR),进而导致两种细胞类型的共同迁移,从而增强肿瘤细胞侵入、渗透进入周围健康的组织。
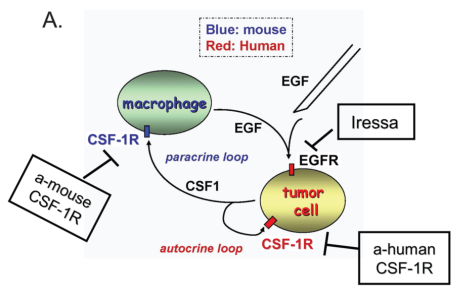
图片来源:Patsialou et al.《cancer research》2009
此外,肿瘤相关巨噬细胞还可通过第二种机制促进肿瘤细胞扩散到脉管系统,有研究表明乳腺癌移植瘤的活体成像表明肿瘤细胞可在血管附近形成快速、协调的多细胞流,并可观察到巨噬细胞与肿瘤细胞相伴,通过模拟肿瘤细胞迁移穿过内皮层的体外血管内渗实验,发现巨噬细胞和肿瘤细胞之间的直接物理接触可触发肿瘤细胞的RhoA依赖性侵袭性伪足形成,从而使肿瘤细胞迁移穿过血管内皮,进入脉管系统扩散至全身。
肿瘤的侵袭转移是一个多步骤多因素影响的复杂过程,肿瘤细胞本身及其微环境对于肿瘤的转移都起到至关重要的作用,对于肿瘤转移模型,早在1889年,Stephen Paget就提出了肿瘤转移的“种子-土壤”学说,认为肿瘤的转移是一个双向的过程,既要种子要有“活力”同时又要求“土壤”合适,这样才有利于“种子”的生根发芽,而M2型肿瘤相关巨噬细胞(TAMs)则作为一种促癌免疫细胞扮演着“沃土”的角色,其与肿瘤细胞的相互作用机制仍有待科学家们继续深入研究。
总之,巨噬细胞就是亦正亦邪,长在不同的器官、组织有不同的表型,正常组织中,就协助抵抗感染和癌变,而在肿瘤中,就可能被“驯化”出协助肿瘤进展的一面。相信通过逐步解决诸如类似TAMs的肿瘤免疫逃逸问题,肿瘤的治愈就能前进一大步。
[1]《医学免疫学》第二版,武汉大学出版社,刘仿、董群、李会强主编
[2]J. Wyckoff, W. Wang, E. Y. Linet al. A paracrine loop between tumor cells and macrophages is required for tumor cell migration in mammary tumors. Cancer Res,2004,64(19):7022-7029
[3]A. Patsialou, J. Wyckoff, Y. Wanget al. Invasion of human breast cancer cells in vivo requires both paracrine and autocrine loops involving the colony-stimulating factor-1 receptor. Cancer Res,2009,69(24):9498-9506
[4]M. Roh-Johnson, J. J. Bravo-Cordero, A. Patsialouet al. Macrophage contact induces RhoA GTPase signaling to trigger tumor cell intravasation. Oncogene,2014,33(33):4203-4212
[5]G. Solinas, S. Schiarea, M. Liguoriet al. Tumor-conditioned macrophages secrete migration-stimulating factor: a new marker for M2-polarization, influencing tumor cell motility. J Immunol,2010,185(1):642-652
[6]S. Gordon. Alternative activation of macrophages. Nat Rev Immunol,2003,3(1):23-35
[7]S. Gordon, P. R. Taylor. Monocyte and macrophage heterogeneity. Nat Rev Immunol,2005,5(12):953-964
[8]J. B. Wyckoff, Y. Wang, E. Y. Linet al. Direct visualization of macrophage-assisted tumor cell intravasation in mammary tumors. Cancer Res,2007,67(6):2649-2656