
资讯中心
作者:香雪精准医疗--陈建君
发布时间:2020-07-21
阅读:13897
癌症泛指恶性肿瘤,一般认为是遗传和环境因素相互作用的结果,严重威胁人类健康。随着高通量测序等技术的高速发展,微生物组对人类健康影响的研究成为了研究热点。越来越多的研究表明,肠道微生物在人体的免疫调节,在癌症的发生、发展和治疗中发挥着重要作用。
肠道微生物
肠道是人体重要的消化吸收的场所,也是最大的免疫器官。肠道中栖居着大量的微生物,种类繁多,主要包括细菌、真菌和病毒。这些肠道微生物被称为人体的第二基因组,其中厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)为其主要优势菌群。经过长期的协同进化,这些微生物和人体建立了一种稳定的共生关系。肠道微生物从宿主中获取生命所需的营养物质,而肠道微生物则帮助宿主完成营养代谢、药物代谢和免疫调节等生理功能。
健康人体中肠道微生物处于一种平衡状态,可维持机体正常的免疫防御功能。这种平衡状态如果被打破,可能会引发多种炎症性疾病、免疫性疾病、以及肥胖、糖尿病等代谢类疾病,甚至会导致癌症和神经系统疾病的发生和发展。
肠道微生物与免疫系统
肠道微生物能促进黏膜和全身免疫系统的成熟和调节。肠黏膜是由肠上皮细胞(IECs)和上皮内淋巴细胞组成的单上皮细胞层。正常状态下,肠道微生物能刺激杯状细胞分泌黏蛋白-2(MUC-2),保障黏液层结构的完整。黏液层的网状结构可以有效防止细菌穿过肠黏膜上皮,发挥屏障功能。Paneth 细胞可诱导抗菌蛋白(AMPs)如抗菌肽、C型凝集素和防御素的合成和分泌,进一步覆盖上皮。抗菌肽除了有抗菌作用,在免疫方面还有促炎性或抗炎性反应的作用。
白细胞介素-17(IL-17)是Th17细胞的主要效应分子,能有效介导炎症反应和自身免疫性疾病。分节丝状菌(Segmented filamentous bacteria, SFB)定植在肠道上皮细胞后,会刺激CD11c+ DC产生IL-6和IL-23,促进Th17细胞分化。Th17细胞分泌的细胞因子包括IL-17,可诱导IECs形成紧密的连接并分泌抗菌肽,因此Th17细胞也在黏膜免疫中起作用。脆弱拟杆菌(Bacteroides fragilis)产生的多糖A(PSA)则能刺激Treg细胞分化,分泌白细胞介素-10(IL-10),可以对抗Th17和Th1的细胞反应。
细菌刺激肠道黏膜相关淋巴组织(GALT)发育主要是通过树突状细胞(DC)对细菌及其代谢产物的识别而实现。肠道微生物产生的代谢物,短链脂肪酸(SCFAs)可以通过浆细胞产生IgA来增强免疫。IgA不仅可阻断细菌对上皮细胞的粘附,还可直接影响细菌的毒力。肠道微生物可以凭借短链脂肪酸合成途径来控制抗菌肽的生成,从而维持免疫内环境的稳定和防止自身免疫疾病的发生。
肠道微生物与癌症的发生
一些肠道微生物能引发癌症。如寄宿在胃黏膜中的幽门螺杆菌(Helicobacter pylori),一旦失去控制,就可能引起慢性胃炎,或导致胃癌的发生。肠道微生物不仅引发原位组织器官癌变,还能通过分泌代谢产物如抗菌素等,改变肠道微生物的结构,从而引发远距离组织器官癌变。如小鼠肠道侵染肝螺杆菌(Helicobacter hepaticus)后,不仅增加结直肠癌的发病率,乳腺癌、肝癌等发病率也有所增加。抗生素的过度使用也会使肠道微生物结构发生改变而引发癌变。
肠道微生物与免疫治疗
免疫系统被认为是控制肿瘤的主导力量,免疫缺陷可能会导致肿瘤的发生、发展,而且会导致肿瘤治疗的不良反应。正常情况下,免疫系统具有免疫监测功能,可以识别并清除肿瘤微环境中的肿瘤细胞。但肿瘤细胞为了在体内生存和增殖,会通过不同的机制抑制免疫系统,逃避免疫系统的识别和攻击,产生免疫逃逸。
近年来,肿瘤免疫治疗在改善肿瘤治疗上取得了重要突破,把治疗的重点从靶向肿瘤细胞本身转移到宿主的免疫系统。抗细胞毒性T淋巴细胞抗原4(CTLA-4)抗体、抗程序性细胞死亡蛋白1(PD-1)抗体以及抗PD-L1 抗体等免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)在肿瘤免疫治疗中取得了较好的研究进展。靶向免疫检查点PD-1和CTLA-4的抗体已经被FDA批准用于黑色素瘤、非小细胞肺癌等多种实体瘤的治疗。然而,肿瘤致病机理复杂、患者个体差异性大,再加上环境等多种因素的影响,最终的治疗效果仍不能使人满意。有研究统计发现,现有的免疫检查点抑制剂(PD-1/CTLA-4)只能对大约25%的患者有效。这时,一个新的影响免疫治疗效果的因素进入了人们的视野。很多研究表明,肠道微生物的组成和代谢产物影响免疫治疗的效果。
2015年,法国免疫学家Laurence Zivogel博士的研究团队发现,使用抗生素后或者无菌的小鼠对CTLA-4抑制剂是没有反应的,但是当给它们口服多形拟杆菌(Bacteroides thetaiotaomicron)、脆弱拟杆菌等肠道微生物时,这些小鼠可恢复对于CTLA-4抑制剂的治疗效果。同年,芝加哥大学的Thomas Gajewski研究团队也证明了肠道中双歧杆菌(Bifidobacterium)的存在有利于PD-L1抑制剂的抗肿瘤效果。
2018年,Laurence Zivogel博士通过临床试验有效地证实了肠道微生物对抗PD-1疗法的重要作用。研究者们对接受过PD-1抑制剂治疗的249位肺癌、肾癌等不同癌症患者进行分析。发现患者在使用广谱抗生素抑菌后,出现了肠道菌群紊乱,导致抗PD-1疗法效果很差,癌症很快就复发了。这些患者的总体生存期(OS)比没有服用抗生素的患者缩短了近45%。取样分析发现,对抗PD-1疗法治疗效果差的患者体内缺乏一种叫做Akkermansia muciniphila的细菌。研究者们通过粪便移植(Fecal microbiota transplantation, FMT)的方法,将患者的肠道菌群移植到无菌小鼠体内。结果发现,免疫疗法有效者的肠道微生物恢复了小鼠对免疫疗法的应答;而免疫疗法无效者的肠道微生物移植后,小鼠依旧对免疫疗法没反应。如果让移植了免疫疗法无效者的肠道菌群的小鼠再口服Akkermansia muciniphila细菌,则能恢复免疫疗法的疗效。芝加哥大学和德州大学MD Anderson癌症中心的研究团队则都聚焦在黑色素瘤上。前者研究发现,对免疫疗法有效患者的肠道微生物中长双歧杆菌(Bifidobacterium longum)、产气柯林斯菌(Collinsellaaerofaciens)和屎肠球菌(Enterococcus faecium)的丰度较高,将他们的肠道微生物移植给无菌小鼠后,可以显著增强小鼠肿瘤免疫应答和肿瘤控制。后者的研究则发现对免疫疗法有效患者体内富含疣微菌(Ruminococcaceae),有效患者肠道细菌的合成代谢通路更为丰富,有着更强的抗肿瘤免疫力。
肠道微生物对免疫反应机制的影响
美国国立卫生研究院(NIH)的Tim Greten博士研究团队发现,肠道微生物可以通过代谢产物胆汁酸特异性调节肝脏中自然杀伤T(NKT)细胞的数量,从而调控肝脏肿瘤的生长。他们的研究不仅证明肠道微生物和免疫反应之间存在关联,还阐述了肠道微生物如何影响肝脏中免疫反应的完整机制。
肝脏和肠道通过门静脉循环相连。在这个系统中,血液从肠流出,通过门静脉,肝脏的血窦来解毒,进入肝静脉,然后再回到心脏和肺。初级胆汁酸是在肝脏中合成,随着胆汁进入肠道中,能被肠道微生物中的梭菌属(Clostridium)细菌转化为次级胆汁酸,少量胆汁酸会随着粪便排出体外,其余的会被肠上皮细胞吸收,通过门静脉血液回到肝脏中,如此循环。研究者使用的三种抗生素中的万古霉素是靶向梭菌属细菌在内的革兰氏阳性菌的。使用万古霉素杀死梭菌属细菌后,初级胆汁酸的转化较少,回到肝脏中的初级胆汁酸增加,刺激肝脏中的肝窦内皮细胞产生更多的负责招募免疫细胞的趋化因子CXCL16。NKT细胞表面表达趋化因子受体6(CXCR6),CXCL16是它唯一的配体,因此可招募NKT细胞在肝脏中聚集。NKT细胞兼具T细胞和自然杀伤(NK)细胞的性质与功能,从而杀伤肿瘤细胞,控制肿瘤的生长(如图1)。
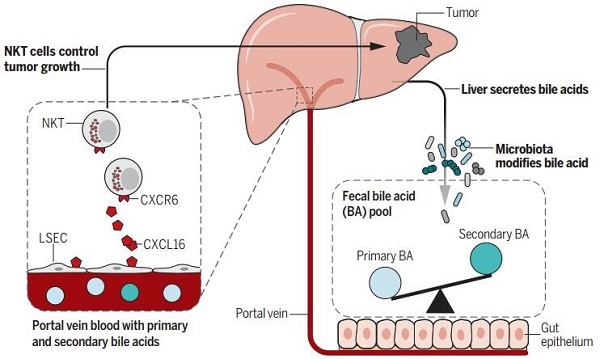
图1. 肠道微生物通过胆汁酸对肝脏中自然杀伤T细胞和肿瘤的调节
图片引自文献[6]
研究人员通过检测肝癌患者的非肿瘤肝脏组织,他们发现CXCL16的表达水平与初级胆汁酸的水平呈正相关关系,与次级胆汁酸呈负相关。说明这个免疫反应机制在人体中也是成立的。
上述的动物实验和临床研究表明,保持肠道微生物的多样化和相对平衡有助于维持机体内稳态。不同个体间微生物菌群存在异质性,肠道微生物的组成差异决定机体免疫差异,从而决定肿瘤免疫治疗差异。合理调控肠道微生物组成,提高有益菌的丰度,可增强肿瘤免疫治疗效果,减轻免疫治疗的不良反应。目前的研究中,得出的影响免疫治疗的肠道菌群不尽相同,抗生素的使用对免疫治疗的增效或者减效也不一致。肠道微生物和癌症的发生机制以及在肿瘤免疫治疗中的机制仍有待研究。深入研究肠道微生物与肿瘤发生和治疗的机制,将有助于癌症的防治,未来可通过肠道微生物及其代谢产物与免疫疗法结合来进行抗肿瘤治疗,以获得更好更安全的疗效,造福更多的癌症患者。
参考文献:
[1] Jandhyala SM, Talukda R, Subramanyam C, et al. Role of the normal gut microbiota. World J Gastroenterol 2015. 21(29): 8787-8803.
[2] 王珊珊, 王佳堃, 刘建新. 肠道微生物对宿主免疫系统的调节及其可能机制. 动物营养学报 2015. 27(2): 375-382.
[3] Routy B, Chatelier EL, Derosa L, et al. Gut microbiome influences efficacy of PD-1-based immunotherapy against epithelial tumors. Science 2018. 359(6371): 91-97.
[4] Gopalakrishnan V, Spencer C, N Nezi, L, et al. Gut microbiome modulates response to anti-PD-1 immunotherapy in melanoma patients. Science 2018. 359(6371): 97-103.
[5] Matson V, Fessler J, Bao R, et al. The commensal microbiome isassociated with anti-PD-1 efficacy in metastatic melanoma patients. Science 2018. 359(6371): 104-108.
[6] Ma C, Han M, Heinrich B, et al. Gut microbiome-mediated bile acid metabolism
regulates liver cancer via NKT cells[J]. Science 2018. 360(6391): eaan5931.