
资讯中心
作者:香雪精准医疗-李鑫
发布时间:2020-03-16
阅读:11480
众所周知人类免疫缺陷病毒(human immunodeficiency virus,HIV),即艾滋病(AIDS,获得性免疫缺陷综合征)病毒,1981年人类免疫缺陷病毒在中美洲首次发现,造成机体细胞及体液免疫功能降低,无法抵御外界病原微生物的侵袭而发生机会性感染、肿瘤等,临床表现多样且目前无法治愈。
HIV属于逆转录病毒的慢病毒属,可以高效的整合进宿主细胞的DNA。这也使得HIV成为理想的用于基因治疗的慢病毒载体。所以病毒的某些特质一方面使得它成为侵害人类健康的元凶,一方面却使得它成为很好用的工具。
1. 什么是慢病毒?
慢病毒(Lentivirus)包括灵长类慢病毒,学名中“Lenti-”在拉丁文中有慢的意思。如人类免疫缺陷病毒(HIV) 和猴免疫缺陷病毒(SIV) ,以及非灵长类慢病毒如猫免疫缺陷病毒( FIV) 、马传染性贫血病毒(EIAV) 、牛免疫缺陷病毒(BIV) 和维斯纳-梅迪病毒(VMV)等。慢病毒的基因组都很复杂,编码一系列不同于其他逆转录病毒的调控蛋白,这使得它们具有独特的调控途径和病毒持久性机制。
2. 什么是慢病毒载体?
慢病毒载体可以将外源基因或外源的shRNA有效地整合到宿主染色体上,从而达到持久性表达目的序列的效果。在感染能力方面可有效地感染神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种类型的细胞,从而达到良好的的基因治疗效果。
目前,HIV-1、HIV-2、SIV、FIV 及EIAV被广泛研究用作基因治疗的载体,而其中又以HIV-1最为热门。与一般的逆转录病毒载体相比,慢病毒载体对分裂细胞和非分裂细胞均具有感染能力因此具有更广的宿主范围。
2.1 HIV-1 病毒形态与结构
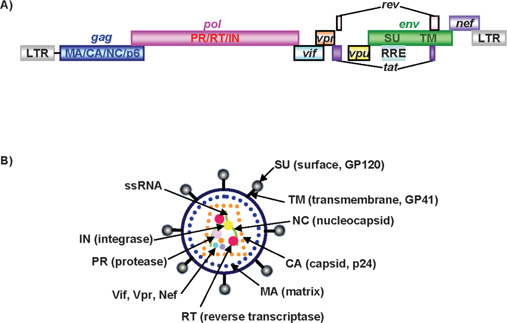
Figure 1. Schematic representation of the HIV-1 viral genome and structure of HIV-1 virion[2]
成熟的HIV-1 病毒直径100~120nm、呈20 面体对称结构、球形,电镜下可见一致密圆锥状核心,内有病毒RNA 分子和酶,后者包括逆转录酶、整合酶(integrase) 和蛋白酶(protease)。HIV-1的最外层为脂蛋白包膜,膜上有表面蛋白 (gp120) 和相嵌蛋白(gp41) 两种糖蛋白,gp120为刺突,gp41为跨膜蛋白。包膜内面为P17 构成的基质蛋白(matrix) ,包膜内为衣壳蛋白(P24)包裹的RNA。
HIV-1 基因组含有9个开放阅读框,编码至少15种与感染周期有关的不同蛋白质,包括结构蛋白和调节蛋白。另外,在病毒生命周期的各个阶段还需要一些顺式作用元件,包括长末端重复序列(LTRs),TAT 激活区(TAR),剪接供体和受体位点,包装和二聚化信号(Ψ),Rev 反应元件(RRE)以及中央和末端多聚嘌呤区(PPT)[1]。
2.2慢病毒载体系统的发展
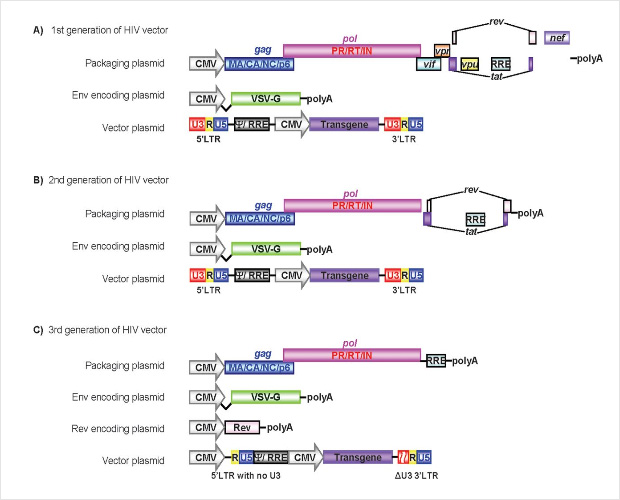
Figure 2. Schematic representation of HIV vectors[2]
第一代基于 HIV-1 的慢病毒载体将载体组分分成三个质粒以增加安全性:(i)包装质粒;(ii)编码病毒糖蛋白的 Env 质粒(包膜质粒); 和(iii)转移质粒[2]。利用基因工程手段特异性删除包装质粒的包装信号或 LTRs 以避免它们传输到载体颗粒,并减少载体制剂中复制型感染性慢病毒(RCLs)的产生[2]。
第二代慢病毒载体系统是在第一代基础上改进的,在包装质粒中删去了HIV的所有附属基因vif、vpu、vpr和nef,以减少产生RCR的风险。这些附属基因的去除并不影响病毒的滴度和转染能力,同时增加了载体的安全性[3]。
第三代慢病毒载体系统由四个质粒组成,增加了两个安全特性:一是构建了自身失活的慢病毒载体,即删除了U3区的3’ LTR,使载体失去HIV-1增强子及启动子序列;二是去除了tat基因,代之以异源启动子序列,这样原始的HIV基因组中的9个基因在慢病毒载体中只保留了3个(gag、pol和rev)[4] ,因此第三代慢病毒载体系统更加安全。
在体外实验及体内实验的研究中,慢病毒己经成为表达外源基因或外源shRNA的常用载体形式之一, 并且正在获得越来越广泛的应用。
参考文献:
1, Trono, D. Lentiviral Vectors (Berlin-Heidelberg, Springer-Verlag, 2002).
2, Sakuma, T., Barry, M. A. and Ikeda, Y. (2012) Lentiviral vectors: basic to translational. J. Biochem. 443, 603–618
3. Zufferey R, Nagy D, Mandel R J, et al. Multiply attenuated lentiviral vector achieves efficient gene delivery in vivo.[J]. Nature Biotechnology, 1997, 15(9):871-5.
4. Dull T, Zufferey R, Kelly M, et al. A third-generation lentivirus vector with a conditional packaging system.[J]. Journal of Virology, 1998, 72(11):8463-8471.