
资讯中心
作者:香雪生命科学研究中心---石佳
发布时间:2018-04-18
阅读:11267
何为“免疫治疗”?引用目前主流互联网学习资源“百度百科”的词条定义:免疫治疗(immunotherapy)是指针对机体低下或亢进的免疫状态,人为地增强或抑制机体的免疫功能以达到治疗疾病目的的治疗方法。但我个人却更喜欢简单粗暴的说法:通过调节机体的免疫系统来进行疾病治疗的方式就是“免疫治疗”。由此可见像细胞因子类的蛋白药、几乎所有的疫苗和抗体药物以及免疫细胞药物均属于免疫治疗的范畴。但似乎公众对于免疫治疗的了解仅局限于免疫细胞范畴,并且主要是因为2016年的“魏则西事件”使得免疫细胞治疗被大众所关注。然而,类似的应用已经在临床上开展了多年。尽管业界乃至学界对于相关疗法的效果一直不以为然。但在监管空白、大众缺乏知识储备与独立判断能力的情况下,各方追逐利益的后果必然是患者买单。所以,即使没有魏则西,也会有“魏则东”、 “魏则南”,出问题是迟早的事。事后,政府各有关部门相继发文禁止体细胞治疗的临床应用,从而出现了整个产业的重新洗牌,小、乱、差公司被清洗出局,而真正有技术实力、雄厚资金支持和严格管理规范的公司乃得以深耕细作。
令人振奋的是在2017年美国FDA先后批准了诺华和凯特针对CD19 的CART细胞药物(Kymriah和Yescarta)上市申请,堪称免疫治疗领域的里程碑事件。与此同时,我国国家食品药品监督管理局(CFDA)先后颁布了生物制品注册分类和申报资料要求(试行)和《细胞治疗产品研究与评价技术指导原则》(试行),明确了细胞治疗类产品可按药品进行注册上市,根据治疗用生物制品相应类别要求进行申报以及注册,通过规范监管的方式引导行业有序发展。至此拉开了产业化序幕,各个公司竞相提交细胞药物注册申报文件,截至2018年3月,在CFDA已有11家企业提交了13项临床试验申请(见下图)。
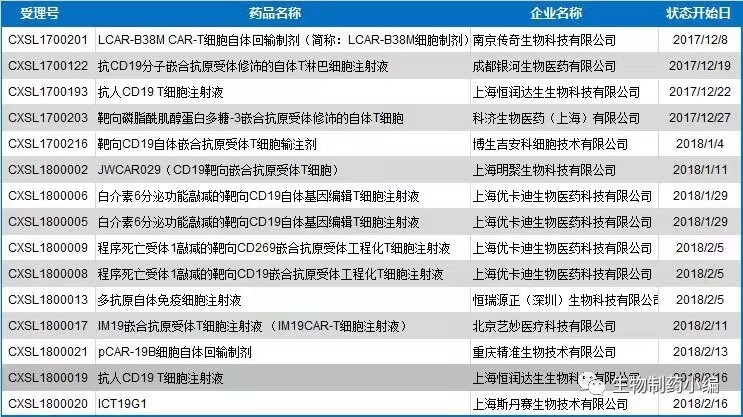
最新消息称CFDA已于今年3月12日批准了南京传奇生物科技有限公司所申报的LCAR-B38M CAR-T细胞自体回输制剂的临床试验申请,目前正处于等待制证过程中。而接下来谁能成为第一个TCR-T细胞制品的临床试验申请获批者,就让我们拭目以待吧!