资讯中心
作者:廖有平
发布时间:2024-11-29
阅读:2816
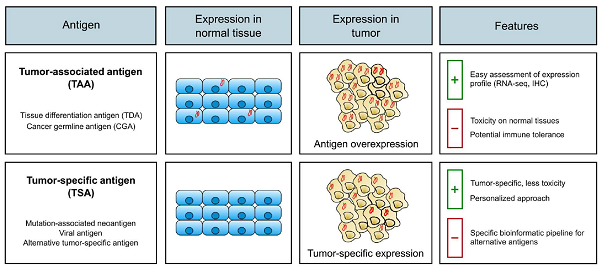
在开发安全有效的TCR-T细胞治疗中,抗原的选择是一个关键点。理想的抗原应该是选择性地、同质性地表达在肿瘤细胞中,并产生能被MHC I类分子递呈到细胞表面的抗原表位。当下,临床试验中应用的两类主要的肿瘤抗原是肿瘤相关抗原(tumor-associated antigens, TAAs)和肿瘤特异性抗原(tumor-specific antigens,TSAs)[1]。
本篇先讲肿瘤相关抗原(TAAs),肿瘤特异性抗原(TSAs)下回见。
TAAs是癌症中过度表达但正常组织中有限表达的抗原。它们的表达被限制于肿瘤起源的组织【组织分化抗原(Tissue Differentiation Antigens, TDAs)】或生殖系组织【癌症生殖抗原(Cancer Germline Antigens, CGAs)】。TAAs是有吸引力的治疗靶点,因为它们通常在患者之间共享。然而,由于TAAs在正常组织中有表达,尽管表达水平低,它们可能与一些“在靶-肿瘤外毒性”有关。此外,高亲和力特异性T细胞在胸腺负筛选过程中可能被消除,这使得强效TCR的鉴定更加困难。
1.组织分化抗原(TDAs)
针对组织分化抗原(TDAs)的临床试验,例如由MART-1 T细胞识别的黑色素瘤抗原、糖蛋白100(gp100)或癌胚抗原(CEA),显示出一定临床反应,但由于这些抗原在正常组织中有少量的表达,因此出现了一些毒性反应。在首次评估MART-1特异性的TCR-T细胞治疗黑色素瘤患者的临床试验中,客观缓解率(ORR)未超过12%(2/17)。为了提高临床反应,一个亲和力增强的识别MART-1的TCR在另外两项临床试验中被测试。两项试验的ORR分别为30%(6/20)和0%(0/13),尽管其中一项试验的临床反应稍有提高,但由于MART-1在正常黑色素细胞中有低表达,出现了一些严重的皮肤、眼睛和听觉的毒性反应。最近,一个针对MART-1的TCR(不同于前面的TCR)的临床试验因前面描述的严重毒性反应和一名患者死亡而被迫提前终止。靶向gp100的TCR-T细胞也出现了类似的结果。黑色素瘤患者的ORR是16%(3/16),但是正如前面报道的,出现了许多皮肤、眼睛或者听觉的不良事件。在此背景下需要提及的是,一种特异性靶向gp100的可溶性的亲和力增强的TCR(与抗CD3单链可变片段融合)——tebentafusp,已获批用于治疗HLA-A*02:01阳性的不可切除转移性葡萄膜黑色素瘤成人患者,这是基于一项3期随机临床试验的结果,该试验显示了显著的总体生存获益。毒性通常为轻度至中度,大多数与治疗相关的不良事件分为皮肤相关(因为gp100阳性的黑色素细胞)或细胞因子介导(因为T细胞的激活)。在评估靶向CEA的TCR-T细胞的临床试验中,3例结直肠癌患者中有1例部分缓解,但所有患者都出现了例如严重的炎症性结肠炎的副作用。其他如胰腺癌中靶向间皮素的治疗也正在进行临床试验(NCT04809766)。
2.癌症生殖抗原(CGAs)
大多数靶向CGAs(又称“肿瘤睾丸抗原”,CTAs)的TCR-T细胞临床试验,集中在黑色素瘤相关抗原(MAGE-A)蛋白家族和纽约食管鳞状细胞癌-1(NY-ESO-1)。 靶向来源于MAGE-A3的两个不同MHC-I类限制性表位的前两个临床试验出现了由交叉反应(对无关表位的识别)引起的严重且致命的毒副作用。在第一个试验中,ORR为56%(5/9),但靶向MAGE-A3的TCR-T细胞与表达在脑组织中的MAGE-A12发生了交叉反应,导致严重的神经毒性和2例死亡。第二个试验因心脏毒性和两例受试者的死亡而被提前终止。事后发现,MAGE-A3-特异性的TCR-T细胞还识别一种来自表达在心肌细胞中的TITIN蛋白的表位。最近,靶向MAGE-A3的MHC-II类限制性的TCR取得了更好的临床结果,ORR为25.3%(4/17),且未出现严重毒性。MAGE-A4也被用于TCR-T细胞的靶向治疗。在以针对食管癌患者的首次试验中未观察到临床应答。然而,靶向另外一个MAGE-A4表位的亲和力增强的TCR-T的试验最近报道了非常令人鼓舞的结果,尤其是在肉瘤中。在2期临床试验SPEARHEAD-1发表时,可评估患者包括33例滑膜肉瘤患者和4例黏液样/圆形细胞脂肪肉瘤患者。ORR为39.4%,疾病控制率为84.8%。在滑膜肉瘤患者中观察到2例完全缓解。22例患者(59%)出现细胞因子释放综合征(CRS),但毒性可控。在非小细胞肺癌患者中靶向MAGE-A10策略的初步临床结果不太令人鼓舞,因为11例患者中只有1例出现短暂的部分缓解(ORR为9%),并报告了包括CRS和神经毒性在内的不良事件。
靶向NY-ESO-1的TCR-T细胞在临床试验中显示出有希望的结果,特别是在黑色素瘤和滑膜肉瘤中。在五项临床试验中治疗的107例患者中,平均应答率为47%(ORR介于20%至67%之间),有8例完全缓解和40例部分缓解,且无严重毒性。在最近的一项使用NY-ESO-1 TCR-T细胞的临床试验中,使用CRISPR-Cas9基因编辑工具敲除了内源性TCR和程序性细胞死亡1(PD-1)。虽然这三例受试者未出现临床应答,但与其他研究NY-ESO-1的试验相比,CRISPR改造的T细胞在体内的持久性得到了提高(36周 vs 1周)。虽然显示出有希望的结果,但NY-ESO-1的表达仍然局限于转移性癌症中,并且其肿瘤表达通常是异质性的。
由香雪生命科学技术(广东)有限公司开发的TCR-T产品TAEST16001,其首个适应症为HLA-A*02:01阳性并且表达NY-ESO-1抗原的晚期软组织肉瘤,I期临床试验结果显示客观缓解率(ORR)达到41.7%(5/12),中位无进展生存期(mPFS)是7.2个月,中位缓解持续时间(mDOR)是13.1个月[2];II期临床研究的早期数据显示出与之前的I期研究一致的安全性和耐受性,根据RECIST1.1,由独立影像评估委员会(IRC)评估的最佳缓解率为50%(4/8),由IRC和研究者评估的mPFS均为5.9个月。
其他CGAs也正在临床试验中进行测试,例如KK-LC-1(NCT03778814 和 NCT05035407 )或PRAME (NCT03686124 和NCT02743611),临床结果尚未公布。
1.Baulu E, Gardet C, Chuvin N, Depil S: TCR-engineered T cell therapy in solid tumors: State of the art and perspectives. Science advances 2023, 9(7):eadf3700.
2.Pan Q, Weng D, Liu J, Han Z, Ou Y, Xu B, Peng R, Que Y, Wen X, Yang J et al: Phase 1 clinical trial to assess safety and efficacy of NY-ESO-1-specific TCR T cells in HLA-A *02:01 patients with advanced soft tissue sarcoma. Cell reports Medicine 2023, 4(8):101133.