资讯中心
作者:香雪生命科学-孙含丽
发布时间:2024-07-02
阅读:5058
随着现代医学技术的不断发展,癌症治疗领域迎来了越来越多的创新疗法。其中,抗体偶联药物(Antibody-drug Conjugate,简称ADC)以其独特的优势,成为了近年来备受瞩目的新型治疗方式。ADC药物由靶向肿瘤细胞过度表达的表面受体的抗体、高活性的细胞毒素小分子和连接子3个部分组成。其中,抗体部分负责将ADC药物分子精准运送至靶细胞表面,连接子负责在靶细胞内或表面释放毒素小分子,而高活性的细胞毒素小分子则高效地杀伤肿瘤细胞。 ADC药物兼具了小分子药物的强大杀伤力和纯单抗的高靶向性,如同“生物导弹”一般,能够精准地打击肿瘤细胞,减少治疗过程中的不良反应。
截至2024年4月全球已有15款ADC药物获批上市,2023年ADC药物全球销售额突破百亿美元,处于各研发阶段的ADC药物分子更是超过800个,而且呈现逐年快速增长的趋势,有望给肿瘤患者带来更有效的治疗药物。
经典的ADC药物由单克隆抗体、连接子和毒素小分子3部分组成(图1)。每个组成部分发挥着不同的功能:抗体部分负责将ADC分子选择性地递送至肿瘤细胞表面,同时通过靶点介导的内吞作用进入到细胞内;连接子则负责在肿瘤细胞内或者表面高效释放毒素小分子,而在血液循环系统中保持稳定;毒素小分子则负责高效地杀伤肿瘤细胞。因此,ADC药物每个组成部分的特性都对其发挥靶向治疗作用至关重要,同时各个组分的选择也都可能会影响到ADC的安全性和有效性。
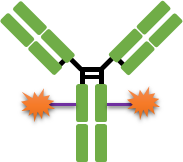
图1 经典ADC药物的结构
本文将从构建ADC时需要考虑的核心要素,包括靶点,抗体、连接子、毒素小分子以及偶联技术等方面概述其研究进展,讨论目前ADC药物开发所面临的挑战和机遇。
1、 靶点
ADC作用机制始于与靶细胞上表达的靶抗原的结合,因此,选择合适的靶点是ADC药物首要考虑因素之一。理想的靶点应该具备以下特点:组织特异性强、抗原稳定性高、抗原高效内化。目前获批ADC药物针对的靶抗原通常是癌细胞过表达的特异性蛋白:HER2、CD19、CD22、CD30、CD33、CD79b、BCMA、Nectin-4、EGFR、TissueFactor、FRα和Trop2。在研ADC药物的热门靶点集中在:HER2、Trop2、EGFR、c-Met、B7-H7、HER3、Nectin-4、CLDN18.2、PDL1等多个成熟的靶点。
2、抗体
作为ADC药物的主体框架结构和导航系统,理想的抗体组分需具备较低的免疫原性、特异性的靶点结合和高亲和力、较长的半衰期、良好的血液循环系统稳定性以及能介导高效的内吞效应等特性。早期的ADC药物采用鼠源抗体,通常会在病人体内引发较强的免疫反应,产生抗药抗体,进而导致疗效降低和其他副反应。后来,为了克服免疫原性这一缺点,改进和优化出了人鼠嵌合抗体和人源化抗体,大大降低了免疫原性风险。除免疫原性外,抗体的高选择性和特异性也对ADC药物的安全性和有效性至关重要,它使得ADC药物能通过结合靶标而富集在肿瘤组织中,而与正常组织不结合或者较低结合。ADC药物的药效与抗体-靶点抗原的亲和力密切相关,目前大部分的ADC与靶点的亲和力在0.1~1.0 nmol/L的范围内。在设计ADC药物时,选择靶点亲和力适当的抗体对于其内吞和药效非常关键。
近些年,除了利用单克隆抗体作为载具的ADC外,也有很多研究尝试使用其他形式的抗体,例如双抗、抗体片段或纳米抗体等来开发ADC,以期进一步提高ADC药物的安全性和有效性。
双抗是一种在单抗的基础上设计出的能同时识别和结合两种不同抗原或同一抗原两个不同表位的一类抗体分子。目前的研究数据表明,有的双抗ADC能提高肿瘤细胞靶向性,增强靶点介导的内吞作用,从而提高药效,降低对正常组织的毒性。
ADC药物目前面临的挑战之一是分子质量过大,难于穿越各种生物屏障到达并穿透实体瘤肿瘤组织,影响其治疗实体瘤的效果。为了提高ADC药物治疗实体瘤的效果,研究者们希望通过缩小抗体框架结构来降低ADC的总体分子大小,增强其肿瘤穿透力。作为ADC药物的框架结构,这些缩小版的抗体首先必须保留其抗原抗体结合能力,如天然抗体的组件F(ab)2、F(ab)2'、Fab和Fv片段等。另外,通过抗体工程改造获得的scFv以及Diabody等则有更好的稳定性和靶向效率。还有一类缩小版抗体则是人源化的非典型抗体片段,如来源于骆驼和羊驼的VHH片段,以及来源于鲨鱼的VNAR片段等,这一类通常被称为纳米抗体。这3种缩小版的抗体都已被用于探索开发缩小版ADC。
3、连接子
连接子负责将ADC的抗体和细胞毒小分子链接在一起,对于ADC药物的安全性和稳定性至关重要。理想的连接子需要在血液循环中足够稳定,能有效避免ADC药物在血液循环中和正常组织中释放毒素小分子并使之保持稳定且非活性状态,而同时又需要能在肿瘤组织和细胞内高效释放毒素小分子。
连接子一般包括4个分子片段:抗体连接片段、调节片段、酶降解片段和自裂解片段。开发者通常依据毒素小分子的特性以及与抗体连接的方式,并结合对ADC分子的影响,开展综合分析评估来筛选上述4个片段,最终确定连接子的结构。
4、毒素小分子
毒素小分子是ADC药物中主要负责执行细胞杀伤功能的组件,它需要具备较高的活性使之能在较低的剂量下有效杀伤肿瘤细胞。同时,它还需要具备很好的稳定性,使之在循环系统和溶酶体中保持结构完整和活性。另外,它还需要分子质量足够小,免疫原性低,也需具备方便与连接子进行化学反应的位点。目前常见的毒素小分子主要包括微管蛋白抑制剂和DNA复制的抑制剂,随着日本第一三共公司的重磅ADC药物Enhertu®应用拓扑异构酶抑制剂的成功,越来越多的细胞毒性相对较低的小分子进入到ADC药物开发者的工具箱,如针对拓扑异构酶的喜树碱类、RNA聚合酶抑制剂、细胞凋亡调控药物等。
5、偶联技术
ADC药物开发成功的另一个重要元素是将小分子组分(连接子或连接子-毒素小分子)加载在抗体分子上的方式和技术。偶联反应策略和过程,决定了载药量(drug antibody ratio,DAR)和载药分布方式等关键质量属性,与ADC药物的有效性和安全性直接相关。理想的ADC偶联策略或技术需具备如下特点:a. 抗体与小分子结合部分的化学键或基团应足够稳定,确保其在循环系统中的稳定性;b. 偶联位点不会干扰抗体的功能,特别是与靶点抗原结合的特异性和高亲和力;c. 偶联过程涉及的反应必须有足够高的选择性和反应效率,同时应易于控制载药量和载药分布。
目前的ADC偶联技术大致可以分为两种类别,一种是利用抗体序列中天然的具备反应活性的氨基酸残基(如表面赖氨酸的侧链氨基和链间二硫键还原后的巯基)来介导的偶联技术,目前已上市的大多数ADC药物采用此类偶联技术;另一类技术,则是通过化学修饰、基因工程技术或者酶修饰等手段在抗体特定位点引入可供反应的基团,再偶联上毒素小分子,实现特定位点偶联。此类技术主要包括工程化半胱氨酸定点插入、非天然氨基酸定点插入、酶介导以及N-糖链介导的偶联技术等。
6、ADC药物未来发展方向
从第一个ADC药物在2000年获批上市到现在的20多年间,共计15款ADC药物获批上市,这期间ADC药物已经在偶联技术、连接子和毒素小分子方面取得显著发展,使得其疗效和安全性得到了很大的提高,也吸引了学术界和工业界对该领域的持续关注和研究投入,同时使得ADC技术得到了更进一步的快速发展,为未来ADC药物的设计和开发提供了广阔的前景。
在ADC药物的靶点选择方面,除了肿瘤细胞表面靶点外,肿瘤微环境的靶点是该领域的新热点之一。此类靶点通常包括肿瘤微环境(tumor microenvironment,TME)中的表皮细胞和成纤维细胞抗原。此类靶点,因其分布在肿瘤组织周围,比肿瘤组织更容易从血液循环接触到ADC分子;再者,此类组织细胞比起肿瘤细胞受到基因突变影响小的多,因此产生耐药性的可能性也降低;作用于此类靶点除了能运用毒素小分子杀伤肿瘤细胞外,还可能产生抗血管生成等协同抑制肿瘤增殖的作用;最重要一点,TME抗原很少或者几乎不在正常组织表达。LRRC15(leucine-rich repeat containing 15)就是此类靶点的代表,它在多种肿瘤的微环境里的成纤维细胞膜表面有高表达,而在正常组织不表达。
由于目前限制ADC效力的一个重要因素是其分子尺寸太大,使之不容易穿透毛细血管以及肿瘤基质等屏障到达肿瘤细胞,从而阻碍了其在实体瘤治疗方面的效果。因此,针对这一局限性,研究者们尝试了各种手段缩小ADC尺寸,包括前述的抗体片段或纳米抗体等形式的ADC。此外,还有一类利用更小尺寸非抗体框架的ADC,其抗体部分由一段有靶向结合能力的多肽替代以进一步增加其穿透力。此类ADC开发的最大挑战就是其血液清除率太快,将来如能克服此缺点将会进一步拓展其治疗适应症,如脑肿瘤和一些血管分布很少的实体瘤。
另一些尝试主要是在载荷方面,如通过在抗体上偶联两种不同的细胞毒小分子,以应对肿瘤组织中癌细胞的高度异质性和耐药性。
此外,还有将ADC中传统的细胞毒小分子载荷替换为蛋白毒素、细胞因子、蛋白降解靶向嵌合体(proteolysis-targeting chimeras,PROTAC)和小核酸作为载荷,用于治疗癌症和其他疾病。
相信在ADC领域研究者的共同努力下,克服现有ADC的缺点和挑战,下一代的ADC药物将会给肿瘤的靶向治疗带来新惊喜,使更多的肿瘤患者获益。另外,作为一种递送系统,相信将来ADC药物必将用于更加广泛的领域,如中枢神经疾病、遗传疾病和感染性疾病等领域,作为真正高效的“魔法子弹”去消灭疾病,拯救生命。