
资讯中心
作者:转载-湾区君
发布时间:2020-06-09
阅读:15706
2019年3月,香雪制药子公司香雪精准研发的TAEST16001注射液,获得国内首个TCR-T新药临床试验许可,引起业界广泛关注。
然而相较于风头正盛的PD-1抗体等免疫疗法,尚在研究阶段的TCR-T仍显得有些冷门。即使就同道中“药”的CAR-T而言,TCR-T也远没有走到获批上市的那一步。今年2月,《科学》在线刊登了一项将CRISPR技术首次应用于TCR-T的临床研究,似乎大有加速这个“新物种”的报批进展。可在此之前,我们仍旧需要回答一系列的问题:什么是TCR-T?它区别于现有免疫疗法的优势在哪?如今又遇到怎样的瓶颈?
5月,“同写意细胞基因治疗俱乐部”正式成立,而从国内外华人圈遴选确定的21位专家所组成的首届理事会里,就包括主导研发出TAEST16001的香雪精准创始人兼CSO李懿。5月底,带着上述问题,“湾区写意”(ID:wanquxieyi)赴广州对李懿进行了专访。
免疫抗癌,离不开的“公检法”系统
2013年,免疫治疗被《科学》杂志评为年度十大科技突破之首。
从分类来看,肿瘤免疫治疗主要有免疫检查点抑制剂、肿瘤疫苗、过继性免疫细胞治疗(adoptive cell therapy)和非特异性免疫调节剂等路径。前两者的代表之一分别为Nivolumab、Sipuleucel-T,而TCR-T(T细胞受体疗法)就属于过继性免疫细胞治疗的一种。
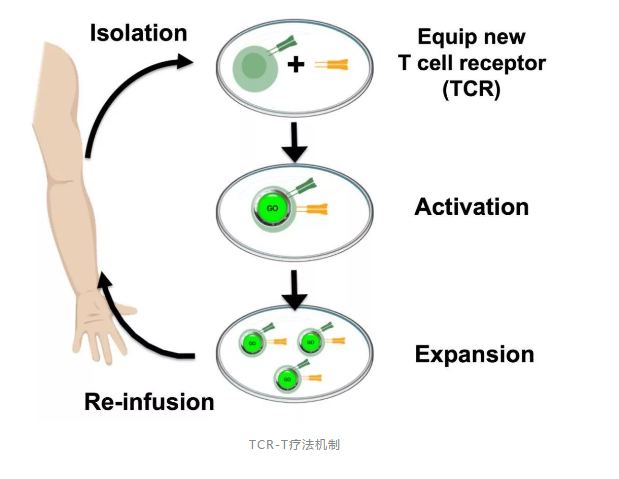
“肿瘤免疫治疗可以通过单一分子药物来实现,也可以通过含有成千上万分子的免疫细胞来完成。”李懿进一步补充道,“后者借助细胞工程技术,修饰相关的免疫细胞,在体外扩增后回输给相应的患者,以增强和激发机体的抗肿瘤免疫能力,并最终达到清除体内肿瘤细胞的目的。”具体到TCR-T,这个被修饰的“免疫细胞”就是T细胞。
李懿时常拿社会中的组织来做比方,T细胞就是监视着人体健康动态的“公检法”系统。T细胞不仅能识别人体细胞的“好”与“坏”,而且有很好的“记忆力”,能够建立对“坏”细胞的重复打击模式。对比免疫检查点抑制剂、肿瘤疫苗等疗法,过继性免疫细胞治疗以人体自身免疫系统为载体,副作用小。
但另一方面,T细胞也会不可避免遇到肿瘤逃逸的难题。
“逃逸的机制有很多,但最关键的一个就是,肿瘤细胞会把抗原的数量降低,比方说降到100或个位数,T细胞就无法做到检测。这些‘骗过’T细胞的肿瘤细胞,最终便可能发展成癌症。”李懿如是举例说,为了建立这种平衡关系,提高T细胞的识别效率,其中一个有效方法就是对其进行针对性改造,而这也是TCR技术的作用所在。
1991年,李懿前往英国曼彻斯特大学担任研究助理,在这之后的10年辗转几家大学、研发机构从事抗体的研发工作。在英国的后10年,他从事TCR药物研发工作。正是这段时间,李懿发明了TCR引导进化技术,并以此优化出全球首个人源高亲和可溶性TCR。2005年,这一成果的相关论文发表于《自然·生物技术》杂志,被认为是TCR药物研发领域的关键性突破,使TCR具备可投入药物使用的价值。
兵贵神速,抗癌亦同此理。如何迅速识别癌细胞并一举清除,是肿瘤免疫治疗的关键。而在这个层面上,李懿认为,几乎所有的肿瘤免疫治疗,都离不开T细胞:PD-1抗体主要是把T细胞“解放”,进而使其消灭肿瘤;而肿瘤疫苗,刺激T细胞后使其清除肿瘤。
TCR-T与CAR-T之辨:同出一脉,各有千秋
2017年,FDA先后批准了两个CAR-T药物上市:一个是诺华的Kymriah,用于治疗急性淋巴细胞白血病;另一个是Kite Pharma的Yescarta,用于治疗复发或难治性大B细胞淋巴瘤。其“治愈性”抗癌疗法,让进入产业化生产的CAR-T名声大震。
不过,按照前述肿瘤免疫疗法的分类,CAR-T并没有那么特别。与TCR-T一样,CAR-T也是过继T细胞疗法之一。二者都需要提取患者外周血中的T细胞,经基因工程修饰,使T细胞表达嵌合抗原受体(CAR)或者T细胞受体(TCR),从而激活并引导T细胞杀死癌细胞。
“这里面就代表了两个具体不同的研究方向。”李懿表示,“CAR-T是建立在人工发明的基础上,原本T细胞受体受到主要组织相容性复合体(MHC)的限制,为此人们想出在其上面安装一个识别抗原的分子的解决方案;TCR-T走的则是自然进化的路线,我们保留它原本的调控机制,只进行稍微的修饰,让它能够特异识别细胞表面抗原密度更低的癌细胞。”
更进一步来看,免疫突触(immunological synapse)是活化T细胞的结构基础,这个结构基于TCR和抗原肽-MHC复合物分子相互作用,促使T细胞的激活和细胞效应的有效发挥。李懿指出,CAR-T与TCR-T各自形成突触的过程是不同的,前者被证实显得无序,而后者则是有序的。虽然二者都能清除癌细胞,但这些差异与是否可调控也许有关。更关键的区别在于,TCR-T靶向的抗原可以是细胞内表达的抗原,而肿瘤特异性的抗原几乎都是这种细胞内抗原。但CAR-T治疗肿瘤所靶向的抗原都几乎是肿瘤相关抗原,即在正常细胞中有较少的表达。这就给CAR-T应用带来一定的风险。
可TCR-T的麻烦的地方在于,针对不同人群的同一抗原要用不同的T细胞受体制作。与之相反,CAR-T可以避免这个困扰,但又衍生出另一些不足。例如,想达到最有效的杀伤,避免毒性,就需要根据不同的状态对CAR-T进行调整。
李懿强调说,目前TCR-T与CAR-T各有优劣,不可偏废。正如肿瘤免疫治疗的诞生并非要否定化疗和放疗,而是对免疫系统本身功能的加强。部分传统疗法能够让患者产生针对肿瘤的免疫反应,可效果往往很难持续。免疫治疗与其他治疗方式相结合,则让医生和患者拥有更多的选择方案。
在此基础上,李懿对TCR-T的探索不断加深。2012年6月,李懿指导主管的一篇题为《单克隆TCR重定向介导杀伤肿瘤细胞》文章在《自然医学》刊登。相关研究表明,提高亲和力的T细胞受体可用于治疗具有表达特异性靶点数量较少的肿瘤,并借此设计出一系列可紧密结合癌细胞的TCR和能同时激活T细胞的双特异分子。这类被命名为“ImmTACs”的新药可用于“劫持”机体现有的正常杀伤病毒功能的T细胞,重新引导它们转而杀伤癌细胞。这又让李懿对TCR-T抱有更高的期待。
“到目前为止,CAR-T细胞疗法的成功还局限于血液肿瘤,对实体瘤则效果很差。TCR-T可以针对实体瘤,这已经是行业的共识。”李懿解释说,CAR-T细胞疗法是通过识别膜表面抗原而发挥作用,而对于近乎九成的恶性实体肿瘤缺乏膜表面特异性靶标,TCR-T细胞则能够识别细胞内来源的肿瘤特异性抗原。
这也意味着,TCR技术拥有更多的靶点种类数量,更能减少免疫逃逸,最终更有效地实现肿瘤细胞的特异性免疫应答,达到精准治疗。据悉,靶向NY-ESO-1的TCR-T细胞已在国内外治疗多种癌症临床试验中,展示出良好的安全性和有效性,是目前最有可能在实体瘤取得突破的T细胞免疫疗法。
立足前沿成败间,远眺香雪下一步
“TCR通往成功的道路可能比CAR要更短一些。”2018年,Fred Hutchinson癌症研究中心的PhilGreenberg撰文回顾了TCR疗法在治疗实体瘤方面机遇和挑战,相关内容发表在《自然》子刊上。
1986年,Michael Steinmetz首次成功将一个T细胞的TCR基因,转移到另一个T细胞中,赋予其相同的抗原特异性。上世纪末,Phil Greenberg带领团队证明,可以通过分离特定TCR赋予T细胞新的抗原特异性。这些早期发现,都与李懿的研究一样,共同构筑了TCR-T走向临床的基础。
但不得不承认,业界对于TCR-T的认识并非没有走过弯路。2011年,美国国家癌症研究所进行的一项TCR治疗实体瘤的临床试验中,9位患者中有3位在接受治疗后立即出现严重精神状态变化,其中两人不幸去世。与此同时,宾夕法尼亚大学的Carl June团队也开展靶向MAGE-A3的TCRs相关研究,同样出现了2位患者迅速出现心源性休克,并于一周内去世。
后来的分析发现,这两次试验所使用的两种MAGE-A3TCR,分别能够和大脑中的多肽MAGE-A12、心脏中的肌联蛋白(titin)所产生的抗原相结合。“这也说明我们的基础研究还不够。”李懿回应说,目前包括TCR-T在内的肿瘤免疫治疗领域,也仍旧面临着因为机制的不完全了解而产生的更大研究障碍,那就是抗原信号扩散。
“众所周知,肿瘤细胞具有异质性,一个细胞表达的抗原可能与另一个细胞之间存在很大的差别。可为什么靶向一个抗原的药物杀死了相应的细胞之后,患者的整个肿瘤都被清除掉?虽然也有文献分析了大致的机理,说T细胞杀伤一个肿瘤细胞之后,形成免疫源性死亡,而后递呈一系列的其他抗原,刺激机体免疫细胞的活化,最终把含有其他抗原的肿瘤细胞清除。但更进一步追问,为什么有的患者治疗路径是上述过程,而另外一些则不能实现抗原信号扩散,进而清除所有的肿瘤细胞?同样是癌症晚期,总不能说有的患者免疫力强,有的患者免疫力弱,所以造成治疗效果的差异吧?”李懿认为,尽管业界对此都是“盲人摸象”,不过这个“基础之问”将是治愈肿瘤的一个关键。
医学出身的李懿,更看重成果的转化应用。带着对肿瘤免疫治疗的思考,李懿在2012年选择回国,希望能够促成这些研究成果的落地。同年,李懿结识了香雪制药董事长王永辉,二人一致商定,计划在香雪制药内部成立生命科学研究中心,并与中国科学院广州生物医药与健康研究院携手创建联合实验室。
孵化了香雪精准之后,李懿从香雪制药争取到5年1.8亿元的资金用于TCR-T项目的推进。其中,TAEST16001在动物实验的表现效果良好,而少量关于肉瘤的人体研究也较为顺利,患者接近于完全缓解(CR)。
“目前我们更多做的是与国际前沿靶点一致的产品,主要是想把这个平台验证出来,然后推动之后的更多研究,包括国内很多特异性的靶点。”李懿补充说,TCR-T的产品管线跟人群基因有密切关系,香雪精准正在布局不同抗原表达的管线,而更为特异性的病种产品也在计划当中。
至于产品可负担问题,李懿倒显得很有信心。在他看来,技术的发展肯定会朝着大众化的方向推进,就如同十几年前的基因测序一样,如今已经从国家层面下沉到消费级领域,所以包括TCR-T在内的细胞治疗也一定会实现成本的下降。现阶段,李懿更担心的是前期研究,尤其是产业协同的软硬件设施和平台,这会极大的影响成果的转化周期。跟长三角地区相比,珠三角对于新药产业的前期积累仍有不足。
“但自我比较来看,粤港澳大湾区的建设已经有很大的进步。区域间的创新要素更为活跃,也会看到越来越多的医药公司在这片地区深耕。希望大家都能利用这个机会,共同为医药产业创新添砖加瓦。”李懿最后如是期待。
撰文 / 不器
本文是同写意原创作品