
资讯中心
作者:香雪精准医疗---张海霞
发布时间:2020-05-09
阅读:14470
CRISPR(Clustered regularly interspaced short palindromic repeats)是原核生物基因组内的一段重复序列,是生命进化历史上,细菌和病毒进行斗争产生的免疫武器,简单说就是病毒能把自己的基因整合到细菌,利用细菌的细胞工具为自己的基因复制服务,细菌为了将病毒的外来入侵基因清除,进化出CRISPR-Cas系统,利用这个系统,细菌可以不动声色地把病毒基因从自己的基因组上切除,这是细菌特有的免疫系统。这个系统由CRISPR序列与CAS(CRISPR associate system)两个核心部分组成。CRISPR序列是由噬菌体DNA片段衍生来的。它可以检测并摧毁能引起相似感染的其他噬菌体中相似的DNA,因此对原核生物抗噬菌体至关重要。CAS是一种核酸内切酶,可以利用CRISPR序列中间隔序列(spacer)对应的RNA指引,识别并且切割特定与其序列互补的DNA链。以最常用的CRISPR/Cas9为例,该系统由反式激活 CRISPR RNA(tracrRNA)基因,CRISPR 重复-间隔基因和CAS9基因组成。这三部分转录生成TracrRNA,Pre-crRNA,还有Cas9蛋白,并组成复合体。这个被激活的复合体会在细菌内部随机的来寻找适合的原间隔序列临近基序(PAM)进行外来DNA筛查。根据对PAM序列的识别,Cas9-RNA复合体将PAM后10-12碱基位的DNA解旋审查。如果被审查的DNA序列与crRNA序列匹配,Cas9内切酶中的HNH核酸酶结构域就会将其切断;同时Cas9中RuvC-like核酸酶结构区域将另一条互补链切断(图1)。
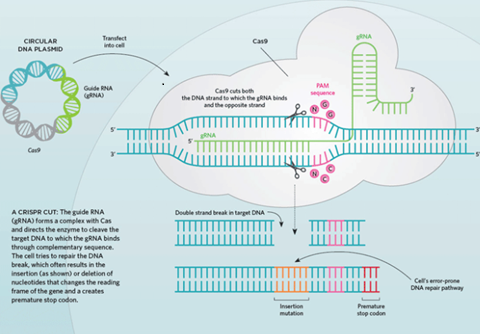
Figure 1 Non-homology end joining (NHEJ) of CRISPR-Cas9 system
CRISPR-Cas9是革命性的基因编辑,它可以在含有成千上万基因的基因组中精确地切割指定DNA双链,伴随着切割工作的是细胞损伤修复。修复一般通过两种方式:在酶的帮助下把两个悬空的末端粘合,通常这会导致1个或多个碱基的增加或删除,这会破坏基因功能(图1),达到敲除基因的目的;另一些酶可以用一段DNA单链匹配被剪切的DNA片段的上游和下游序列,建立互补DNA链完成双链修复(图2)。前者被称为非同源末端连接,是CRISPR切割导致的最常见情况。后者被称为同源定向修复,发生的频率根据不同细胞类型具有选择性倾向。
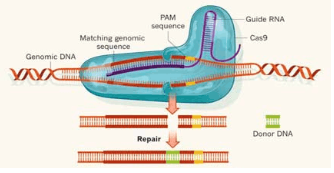
Figure 2 Homologous recombination repair (HR) of CRISPR-Cas9 system
尽管世人对CRISPR-Cas9基因编辑抱有很高期望,科学家们仍对其人体临床应用持怀疑态度。为什么呢?按哥伦比亚大学Sam Sternberg教授的说法,现在的CRISPR工具就像是分子剪刀。它们能剪开DNA,但实际上的编辑工作是交给了细胞自身的修复机制,目前还没人知道把它放入细胞后真正会发生什么,我们并没有真正理解过这一过程是如何运作的。这套机制在过去已被证明行之有效,但也暴露出了不少潜在的问题,譬如许多细胞在修复DNA时,会引入一些错误。又譬如一些细胞在双链DNA断裂之后,会出现意想不到的副作用。为了突破传统工具的局限,研究人员们决定引入不依赖细胞本身修复机制的基因编辑元件。最近,研究人员从霍乱弧菌体内发现一种“转座子”(Tn7-like transposons),也称跳跃基因。顾名思义,它们能够让基因发生“跳跃”,并整合到基因组的不同位点中。研究人员们指出,这种整合功能并不涉及同源重组修复,也就是经典CRISPR-Cas系统的编辑方法。利用CRISPR联合这种转座子,研究人员们开发了一种全新的基因编辑系统。与其说它是一把“剪刀”,不如说它是一管“胶水”。利用CRISPR体系,它前往基因组的特定位点。随后,它能以一种高度可控的方法,把外源基因整合入基因组(图3)。实验结果表明,他们能将任何不超过10kb的DNA序列插入到任何细菌基因组的特定位点。这套全新的工具带来了全新的应用前景。研究人员们指出,这有望让CRISPR基因编辑工具在保持简便使用的同时,避免与DNA断裂相关的潜在副作用[1]。
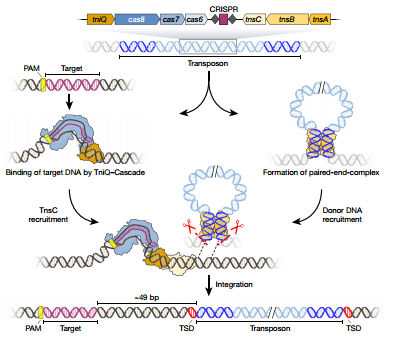
Figure 3 Proposed model for RNA-guided DNA integration by Tn7-like
transposons encoding CRISPR–Cas systems.
CRISPR/Cas系统想要精确地切割指定DNA双链,除了需要作为识别重点的CRISPR序列,还需要另外一个重要的序列PAM。如果没有对应的PAM,就启动不了CRISPR/Cas系统。PAM根据Cas酶的种类不同而有所不同,目前使用最广泛的是来自化脓链球菌的SpCas9,主要识别的是NGG序列。这就意味着它并不能够随我们所欲地编辑所有的基因片段。而一项最新的研究则完全放开了CRISPR/Cas9的束缚,现在“基因魔剪”可以说是真的“想剪哪里就剪哪里啦”。对蛋白来说,结构决定功能。SpCas9识别NGG,主要是通过R1333和R1335两个位置氨基酸侧链和鸟嘌呤的结合。科学家通过比对SpCas9-VQR、SpCas9-VRQR等前人开发的变体和它们识别的PAM序列,很快提出了几个可能的氨基酸取代方案,并通过一种高通量测试PAM活性的方法(HT-PAMDA)来分析变体对PAM的偏好。最终,在各种氨基酸取代组合方案里,研究者们获得了一种能够基本等效识别NGA、NGC、 NGG、NGT的变体,它具有五个氨基酸取代(D1135L/S1136W/G1218K/E1219Q/R1335Q/T1337R),被命名为SpG。搞定了NGN后,研究者们进一步把R1333位置替换成丙氨酸、半胱氨酸或脯氨酸。经过一系列细化和筛选,最终研究者们开发出了SpG(L1111R/A1322R)2.0版SpRY,可识别NRN(R为A+G)。不言而喻,SpG和SpRY大大扩大了CRISPR/Cas系统的极限,几乎整个基因组都“触手可及”了[2]!另外,根据实验数据,SpG和SpRY的脱靶效应与SpCas9水平接近,新增的脱靶问题主要来源于扩展大的PAM范围,而另外一种HF1变体则能够消除这类脱靶并提升编辑效率。
十几年前,当研究人员开始解析CRISPR结构的时候,他们并没有预料到这会给基因编辑世界带来一场革命性风暴。这种突破性的技术影响极其深远,从改变老鼠皮毛的颜色到设计不传播疟疾的蚊子和抗虫害作物,再到修正镰状细胞性贫血等各类遗传疾病,突变CCR5基因抵抗艾滋病等等[3]。该技术具有非常精准、廉价、易于使用,并且非常强大的特点。随着CRISPR技术的逐渐完善、升级,只要能正确合理的利用,CRISPR将极大地推动生命科学的发展与进步。
参考文献:
[1]Sanne E. Klompe, et al. (2019), Transposon-encoded CRISPR–Cas systems direct RNA-guided DNA integration, Nature, DOI: https://doi.org/10.1038/s41586-019-1323-z
[2] Walton RT, Christie KA, Whittaker MN, Kleinstiver BP.(2020),Unconstrained genome targeting with near-PAM less engineered CRISPR-Cas9 variants. Science, Doi: 10.1126/science.aba8853.
[3] Leonova EI, Gainetdinov RR.(2020),CRISPR/Cas9 Technology in Translational Biomedicine. Cell Physiol Biochem. , Doi: 10.33594/000000224.