
资讯中心
作者:香雪生命科学研究中心-秦浩森
发布时间:2019-07-23
阅读:14368
在慢性感染或癌症中,T细胞会暴露在持续的抗原或炎症信号当中。当T细胞处于此情况之下往往会出现功能的退化,这种状态就被称为耗竭。耗竭的T细胞会表达抑制性受体并失去效应功能。因此耗竭的T细胞经常会难以控制持续的感染或肿瘤发展的病情。
在急性的感染中,初始T细胞会在1-2周内被激活并分化为效应细胞。在活化与分化过程中细胞会迅速增殖和发生转录、表观及代谢改变,从而获得效应T细胞的基本特征:效应功能和外周组织归巢能力[1] [3]。外来抗原被清除后,大部分被激活的T细胞都会走向死亡,仅有部分细胞会转化为记忆T细胞。这些记忆T细胞会下调效应能力,但当他们再次遭遇抗原时会快速恢复效应功能[3]。
而在慢性感染或癌症中,T细胞却走向了另一方向。由于长期暴露于抗原刺激或炎症环境中,T细胞的分化程序发生了改变并导致T细胞耗竭。耗竭的T细胞会出现以下的几个特征:逐渐失去效应功能,持续上调多种抑制受体,改变某些关键的转录因子及其表达,发生代谢紊乱和不能过渡为记忆T细胞的稳态反应[4-6]。因此当T细胞出现耗竭时将不能有效控制感染和肿瘤。
既然T细胞耗竭不利于免疫防御,那它到底是怎么形成的呢?我们又该怎么阻止它呢?
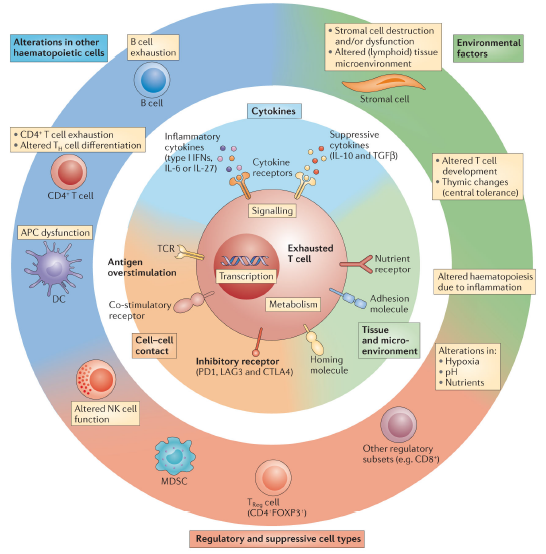
如下图所示,调节T细胞衰竭的途径可以分为以下几类[2]:
1、 细胞与细胞间的信号:包括T细胞受体接合(信号1)时间延长、共刺激和/或共抑制信号(信号2)
2、 可溶性细胞因子的过量表达,如炎症因子type 1 interferons、抑制性因子IL-10及转化生长因子TGFβ等
3、 由趋化因子受体、粘附分子和营养受体的表达水平变化所驱动的组织和微环境影响
4、 组织分布和/或迁移模式改变,并导致感应氧张力的途径(von Hippel-Lindau肿瘤抑制因子(VHL)和/或缺氧诱导因子(HIF)途径)、pH和营养水平改变。
5、 组织破坏和淋巴组织改变。
在慢性感染或癌症中,细胞内部及外部信号都会影响T细胞的分化并促进T细胞的耗竭。
T细胞的耗竭并不等于T细胞的衰老或终末分化。虽然T细胞在耗竭期间处于功能障碍的状态,但是科学家发现这种状态是可以逆转的。目前科学家主要以阻断抑制受体作为解决T细胞耗竭的手段,相关的研究已转化为PD-1/PD-L1抗体药物并通过了美国FDA批准上市,并成为癌症治疗的明星药。有研究证明,联合使用阻断PD-1和激动4-1BB的抗体来治疗慢性感染可以明显逆转耗竭T细胞的功能并有效控制病毒感染。
参考文献
[1] Kaech SM, Cui W ect. Transcriptional control of effector and memory CD8+ T cell differentiation[J]. Nat. Rev. Immunol, 2012, 12:749–761.
[2] E. John Wherry, Makoto Kurachi. Molecular and cellular insights into T cell exhaustion[J]. Nat Rev Immunol, 2015, 15(8): 486–499.
[3] Masopust D, Schenkel JM ect. The integration of T cell migration, differentiation and function[J]. Nat. Rev. Immunol, 2013, 13:309–320.
[4] Wherry EJ. T cell exhaustion[J]. Nat. Immunol, 2011, 131:492–499.
[5] Schietinger A, Greenberg PD. Tolerance and exhaustion: defining mechanisms of T cell dysfunction[J]. Trends Immunol, 2014, 35:51–60.
[6] Doering TA, et al. Network analysis reveals centrally connected genes and pathways involved in CD8+ T cell exhaustion versus memory. Immunity. 2012; 37:1130–1144.
文中部分图片源于网络,版权归作者所有。